Forskere identificerer enhjørningsforsvarsmekanisme, der beskytter bakterier mod antibiotika
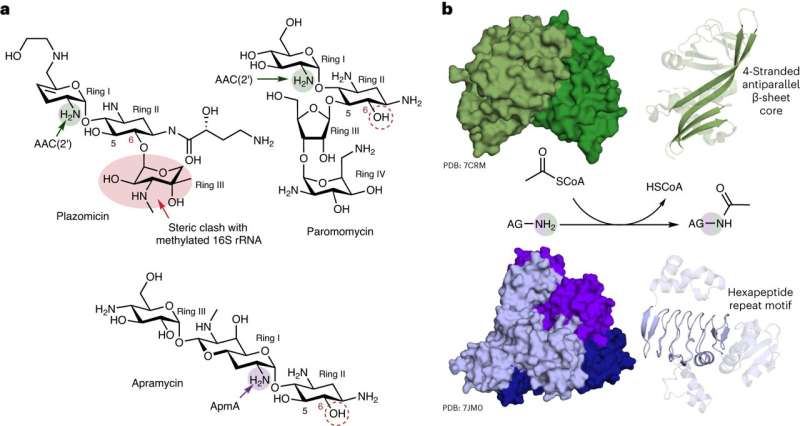
Forskere ved McMaster University har opdaget unikke egenskaber ved en mekanisme, der bruges af bakterier til at modstå en vigtig klasse af antibiotika. Den nye forskning, offentliggjort i Nature Chemical Biology , viser, at resistens over for aminoglycosid-lægemidler - der bruges til at behandle en række infektioner - er langt mere kompleks end først antaget.
Ledende efterforsker Gerry Wright, professor i biokemi og biomedicinske videnskaber ved McMaster, siger, at hans laboratorium observerede aldrig før set alsidighed i ApmA, et længe undersøgt bakteriel resistensgen. Forskningen viste, at genet ukarakteristisk kan sætte bakterier i stand til at udføre forskellige funktioner mod forskellige antibiotika.
Af de hundrede eller flere aminoglykosid-resistensenzymer kendt af forskere, siger Wright, at kun denne ene har udvist en så smidig adfærd.
"Det er en enhjørning," siger han. "Det ser anderledes ud, det fungerer anderledes, og det tilhører en helt anden familie af enzymer. Det er helt anderledes end alle de resistensmekanismer, som vi forbinder med denne klasse af antibiotika."
Wright, medlem af Michael G. DeGroote Institute for Infectious Disease Research, siger, at aminoglykosider var blandt de tidligste antibiotika med klinisk relevans - og de første nogensinde til at være nyttige mod tuberkulose. Men fordi de er blevet ordineret siden 1940'erne, siger han, at "modstand mod dem er blevet et reelt problem" - undtagen i tilfælde af apramycin.
"Antibiotikummet apramycin undgår de fleste resistensmekanismer, og derfor er det en stærk kandidat til nye kliniske anvendelser," siger han. "Desværre er denne mekanisme, som vi har undersøgt, ikke en, som stoffet kan undgå."
Wright siger, at hans laboratoriums nylige opdagelse er væsentlig, fordi apramycin i øjeblikket er i kliniske forsøg, og hvis det passerer igennem, vil det være afgørende at have en grundig forståelse af, hvordan bakterier kan modstå stoffet, for at udvide dets anvendelighed.
"Hvis vi vil bringe dette stof på markedet, så [må] vi hellere vide, hvad fjenden er," siger han. "Hvis man lærer mere om denne unikke resistensmekanisme, kan det være med til at informere opfølgende forskning i næste generation af apramycin eller diagnostik, der kunne påvise ApmA i bakterier."
Flere oplysninger: Emily Bordeleau et al, Mechanistic plasticity in ApmA muliggør aminoglykosid promiskuitet for resistens, Nature Chemical Biology (2023). DOI:10.1038/s41589-023-01483-3
Journaloplysninger: Kemisk naturbiologi
Leveret af McMaster University
 Varme artikler
Varme artikler
-
 Titaniumcarbidflager opnået ved selektiv ætsning af titaniumsiliciumcarbidKredit:Wiley Metallisk ledningsevne og hydrofilicitet af MXenes har etableret dem som elektroder i genopladelige batterier og superkondensatorer, såvel som andre applikationer, herunder fototermis
Titaniumcarbidflager opnået ved selektiv ætsning af titaniumsiliciumcarbidKredit:Wiley Metallisk ledningsevne og hydrofilicitet af MXenes har etableret dem som elektroder i genopladelige batterier og superkondensatorer, såvel som andre applikationer, herunder fototermis -
 Konstrueret elektrodemateriale flytter batteriudviklingen tættere på hurtig opladningDet sorte phosphor-kompositmateriale forbundet med carbon-phosphor-kovalente bindinger har en mere stabil struktur og en højere lithiumion-lagringskapacitet. Kredit:DONG Yihan, SHI Qianhui og LIANG Ya
Konstrueret elektrodemateriale flytter batteriudviklingen tættere på hurtig opladningDet sorte phosphor-kompositmateriale forbundet med carbon-phosphor-kovalente bindinger har en mere stabil struktur og en højere lithiumion-lagringskapacitet. Kredit:DONG Yihan, SHI Qianhui og LIANG Ya -
 Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m
Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m -
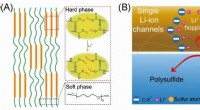 Stabiliserende svovlkatode med enkelt Li-ion-kanal polymerbindemiddel(A) Skematiske diagrammer over dannelsen af polymeren med enkeltionkanalerne. (B) Skematiske diagrammer af enkelt-ion-kanaler regulerer polysulfid- og Li-ion-hopningen. Kredit:©Science China Press
Stabiliserende svovlkatode med enkelt Li-ion-kanal polymerbindemiddel(A) Skematiske diagrammer over dannelsen af polymeren med enkeltionkanalerne. (B) Skematiske diagrammer af enkelt-ion-kanaler regulerer polysulfid- og Li-ion-hopningen. Kredit:©Science China Press
- Ny metode til måling af tab af signal i langt-infrarøde instrumenter
- Video:Natto, den stinkende, slimet sojasnack
- Sådan konverteres hele numre til procent
- Kemikere udvikler rammer for at muliggøre effektiv syntese af informationstætte molekyler
- Apples nye tv-annonce viser, at de håber, at du bekymrer dig lige så meget om privatlivets fred på…
- Nye rengøringsmidler til lægemiddelforskning


