På jagt efter aktive stoffer mod stress-relaterede sygdomme
Depression, fedme eller kronisk smerte - alle disse lidelser kan udløses eller fremmes af stress. I to publikationer viser forskere ved TU Darmstadt nye måder at behandle stress-relaterede sygdomme på.
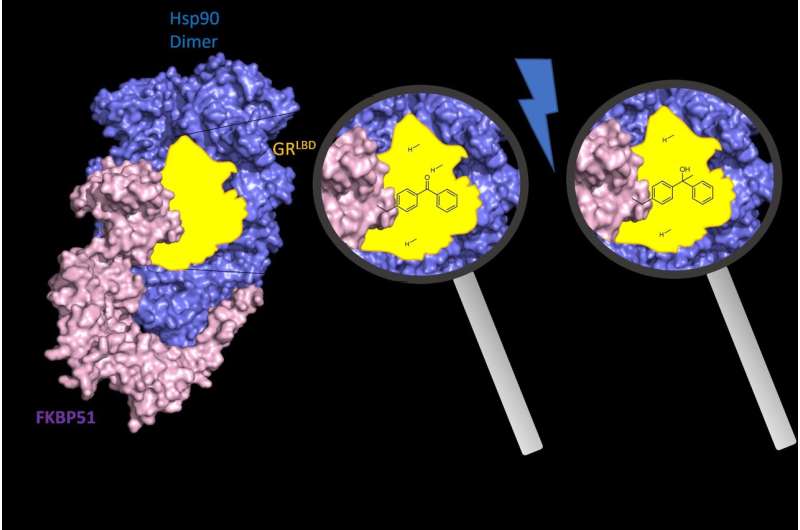
I tidsskriftet Nature Structural &Molecular Biology , Felix Hausch og medarbejdere ved Kemisk Institut og Center for Syntetisk Biologi ved TU Darmstadt belyst arkitekturen og den funktionelle mekanisme af FKBP51 og FKBP52 i kompleks med glukokortikoidreceptoren og chaperonen Hsp90, det protein, der er nødvendigt for aktiveringen af glukokortikoid receptor.
De to proteiner styrer steroidhormonreceptorerne (for eksempel glukokortikoidreceptoren), som behandler blandt andet kroppens stress- og hormonsignaler. De er kendt, spiller nøgleroller i henholdsvis stress-relaterede lidelser og korrekt embryonal udvikling. Hvordan FKBP51 og FKBP52 virker på steroidhormonreceptorer er ukendt.
"Ved systematisk inkorporering af fotoreaktive aminosyrer i menneskelige celler var vi i stand til for første gang at kortlægge de intime kontakter mellem FKBP51 og FKBP52 med glukokortikoidreceptoren inde i levende menneskelige celler," forklarer Asat Baischew, der afsluttede sin doktorgrad i Hausch-gruppen og er den første forfatter til publikationen.
"Dette gjorde det muligt for os at rekonstruere et øjebliksbillede af glukokortikoidreceptoren før aktivering i det tidligere undvigende trin, hvor det er reguleret af FKBP'erne," tilføjer Sarah Engel, Ph.D. studerende og anden nøgleforfatter til publikationen.
Disse undersøgelser viser, hvordan FKBP51 og FKBP52 interagerer differentielt med glukokortikoid-receptoren, forklarer den differentierede farmakologi af FKBP51-ligander og giver et strukturelt grundlag for udviklingen af FKBP-bindende stoffer (ligander) ligander med højere effektivitet. Resultaterne åbner nye veje for opdagelsen af forbedrede lægemidler til depression, fedme-induceret diabetes eller kronisk smerte.
En anden nylig udgivelse af AG Hausch i tidsskriftet Angewandte Chemie behandler spørgsmålet om, hvordan disse behandlingsmuligheder konkret kan forfølges. Forskerne fokuserede specifikt på proteinet FKBP51. Nylige biokemiske fund har dog vist, at stoffer, der er tilgængelige i øjeblikket, binder til FKBP51, men ikke blokerer dets regulerende effekt på stresshormonreceptorer.
Forskere ved AG Hausch har nu udviklet såkaldte PROTACs (Proteolysis Targeting Chimeras) til FKBP51. Dette gør det muligt for første gang farmakologisk at nedbryde det komplette FKBP51-protein i levende menneskeceller i stedet for kun at hæmme dele af det, som det tidligere var tilfældet.
"FKBP51 viste sig at være ekstremt resistent over for induceret proteinnedbrydning," forklarer Thomas Geiger, Ph.D. elev og førsteforfatter til publikationen. "I modsætning til det relaterede mindre protein FKBP12, skulle over 220 PROTAC-varianter syntetiseres og testes, før molekylet SelDeg51 blev fundet, der har tilstrækkelig aktivitet og selektivitet i celler."
Undersøgelsen åbner op for en fundamentalt ny tilgang til at målrette de molekylære funktioner af FKBP51. De næste skridt er at videreudvikle disse resultater til forbedret medicin mod stress-relaterede sygdomme.
Flere oplysninger: Baischew et al, Storskala, in-celle fototværbinding ved enkelt-rest opløsning afslører det molekylære grundlag for glukokortikoid receptor regulering af immunofiliner, Nature Structural &Molecular Biology (2023). DOI:10.1038/s41594-023-01098-1
Thomas M Geiger et al, Discovery of a Potent PROTAC muliggør målretning af FKBP51's stilladsfunktioner, Angewandte Chemie (2023). DOI:10.1002/ange.202309706 Asat
Journaloplysninger: Naturens strukturelle og molekylære biologi , Angewandte Chemie
Leveret af Technische Universitat Darmstadt
 Varme artikler
Varme artikler
-
 Nye ringslutningsreaktioner til syntetisering af makrocykliske lægemiddelledningerIntegreret robotarbejdsstation brugt på EPFLs Biomolecular Screening Facility til at udføre kombinatorisk syntese af makrocykler og efterfølgende high-throughput målbaserede screeningsassays. Kredit:A
Nye ringslutningsreaktioner til syntetisering af makrocykliske lægemiddelledningerIntegreret robotarbejdsstation brugt på EPFLs Biomolecular Screening Facility til at udføre kombinatorisk syntese af makrocykler og efterfølgende high-throughput målbaserede screeningsassays. Kredit:A -
 Ny metode åbner vejen for skærende værktøjer med længere levetidKostas Sarakinos, Davide Sangiovanni og Georgio Almyras. Kredit:Anna Nilsen Forskere ved Linköpings Universitet, LiU, har udviklet en teoretisk model, der muliggør simuleringer for at vise, hvad d
Ny metode åbner vejen for skærende værktøjer med længere levetidKostas Sarakinos, Davide Sangiovanni og Georgio Almyras. Kredit:Anna Nilsen Forskere ved Linköpings Universitet, LiU, har udviklet en teoretisk model, der muliggør simuleringer for at vise, hvad d -
 Nye forbindelser fra søstjerner i Kuril -bassinet viser effektivitet mod kræftceller.Kredit:CC0 Public Domain Russiske forskere fra Far Eastern Federal University (FEFU), G. B. Elyakov Pacific Institute of Bioorganic Chemistry (PIBOC FEB RAS), og A.V. Zhirmunsky National Scientifi
Nye forbindelser fra søstjerner i Kuril -bassinet viser effektivitet mod kræftceller.Kredit:CC0 Public Domain Russiske forskere fra Far Eastern Federal University (FEFU), G. B. Elyakov Pacific Institute of Bioorganic Chemistry (PIBOC FEB RAS), og A.V. Zhirmunsky National Scientifi -
 Super vandafvisende materialer er nu holdbare nok til den virkelige verdenEn skematisk fremstilling af, hvordan overfladen ser ud, og hvordan strukturen afviser vand. Kredit:Aalto Universitet Superhydrofobe overflader afviser vand som intet andet. Dette gør dem yderst a
Super vandafvisende materialer er nu holdbare nok til den virkelige verdenEn skematisk fremstilling af, hvordan overfladen ser ud, og hvordan strukturen afviser vand. Kredit:Aalto Universitet Superhydrofobe overflader afviser vand som intet andet. Dette gør dem yderst a
- Svagt bundet salt er en nøgleingrediens til højrenhed Li@C60 film
- Ufarlig eller dødbringende? Undersøgelse af udviklingen af E. coli
- Forøgelse af termokraft af oxider via kunstigt lamineret metal/isolator-heterostruktur
- Forbrugerrapporter:Skjulte kabel -tv -gebyrer kan koste dig $ 450 ekstra årligt
- Brug af den menneskelige hånd som en magtesløs infrarød strålingskilde
- Matematikkens mystik:5 smukke matematiske fænomener


