Forskere belyser, hvordan et nitrogenfikserende enzym også producerer kulbrinter
Her belyser forfatterne detaljerne i de enzymatiske reaktioner, der ligger til grund for produktionen af kulbrinter ved nitrogenase. Holdet demonstrerer, at udover nitrogenases tidligere karakteriserede rolle i at omdanne nitrogen til ammoniak, kan enzymet også generere kortkædede kulbrinter og hydrogen gennem reduktion af vand og protoner. Mekanistiske eksperimenter afslørede, at det samme FeMoco-aktive sted, der katalyserer N2-reduktion, også medierer kulbrintedannelse, hvilket tyder på, at disse to processer er indviklet forbundet.
Dette arbejde fremhæver nitrogenases alsidighed og giver indsigt i den grundlæggende kemi, der ligger til grund for enzymets substratpromiskuitet. Resultaterne udvider vores forståelse af nitrogenases evner og bidrager til udviklingen af nye strategier for kulbrinteproduktion og nitrogenfiksering i industrielle og landbrugsmæssige omgivelser.
 Varme artikler
Varme artikler
-
 Undersøgelse fremhæver lovende galliumoxider for næste generation af strålingsdetektorerKredit:CC0 Public Domain Ny forskning fra North Carolina State University viser, at strålingsdetektorer, der gør brug af enkeltkrystal galliumoxid, gør det muligt at overvåge røntgenstråling i næs
Undersøgelse fremhæver lovende galliumoxider for næste generation af strålingsdetektorerKredit:CC0 Public Domain Ny forskning fra North Carolina State University viser, at strålingsdetektorer, der gør brug af enkeltkrystal galliumoxid, gør det muligt at overvåge røntgenstråling i næs -
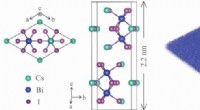 Odds er gode for unikke 2-D-forbindelserTil venstre, top- og sidebilleder af krystalstrukturerne af perovskit-afledt Cs3Bi2I9, et materiale syntetiseret ved Rice University, der viser valleytronics-kapaciteter. Hver enhedscelle indeholder t
Odds er gode for unikke 2-D-forbindelserTil venstre, top- og sidebilleder af krystalstrukturerne af perovskit-afledt Cs3Bi2I9, et materiale syntetiseret ved Rice University, der viser valleytronics-kapaciteter. Hver enhedscelle indeholder t -
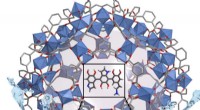 Fjernelse af tungmetaller fra vand med MOF'erEn organisk metalramme kan fjerne bly fra vandprøver, få dem til EPA-godkendte niveauer på få sekunder. Kredit:American Chemical Society Det anslås, at 1 milliard mennesker ikke har adgang til ren
Fjernelse af tungmetaller fra vand med MOF'erEn organisk metalramme kan fjerne bly fra vandprøver, få dem til EPA-godkendte niveauer på få sekunder. Kredit:American Chemical Society Det anslås, at 1 milliard mennesker ikke har adgang til ren -
 Hvordan positivt og negativt ladede ioner opfører sig ved grænsefladerForskere fra RUB og deres samarbejdspartnere har undersøgt, hvad der sker i grænsefladen mellem en vandig opløsning og en ladet overflade. Kredit:RUB, Kramer Hvordan positivt og negativt ladede ion
Hvordan positivt og negativt ladede ioner opfører sig ved grænsefladerForskere fra RUB og deres samarbejdspartnere har undersøgt, hvad der sker i grænsefladen mellem en vandig opløsning og en ladet overflade. Kredit:RUB, Kramer Hvordan positivt og negativt ladede ion
- Livscyklus for Obelia
- NASA afslører tidsplan for Artemis 2024 Moon-mission
- Lys (fysik): Hvad er det og hvordan fungerer det?
- Strukturel nedbrydning af dekadale klimaforudsigelsesfejl
- Disney lancerer streaming med reduceret båndbredde i 7 europæiske lande
- Forskere bruger uorganiske ingredienser til at begrænse defekter af perovskite solceller, bevarer e…


