Kemikere viser, at det katalytiske udvalg af enzymer kan udvides
Enzymer er proteinmolekyler, der katalyserer kemiske reaktioner i levende organismer. De er meget selektive og effektive, hvilket gør det muligt for komplekse reaktioner at forekomme under milde reaktionsbetingelser. Imidlertid er substratomfanget af enzymer ofte begrænset, hvilket betyder, at de kun kan katalysere et snævert udvalg af reaktioner.
"At udvide det katalytiske repertoire af enzymer er et langvarigt mål inden for kemi og bioteknologi," siger Tobias Erb, professor i kemisk biologi og genetik ved JGU. "Dette ville give os mulighed for at bruge enzymer til en bredere vifte af syntetiske reaktioner og potentielt udvikle nye biokatalytiske processer til produktion af lægemidler og andre finkemikalier."
En måde at udvide enzymernes substratomfang er at konstruere dem ved at introducere mutationer eller kemiske modifikationer. Denne tilgang er dog ofte trættende og tidskrævende, og det kan være svært at forudsige, hvilke modifikationer der vil føre til den ønskede katalytiske aktivitet.
"Vi ønskede at udvikle en mere generel strategi, der ville give os mulighed for at udvide det katalytiske udvalg af enzymer på en rationel og effektiv måde," forklarer Christopher Gregg, en postdoc-forsker i Erbs gruppe. "Vi blev inspireret af det faktum, at mange enzymer indeholder metalioner, der er essentielle for deres katalytiske aktivitet."
Forskerne antog, at ved at indføre et metalbindingssted i et eksisterende enzymstillads kunne de skabe et kunstigt metalloenzym med en ny katalytisk aktivitet. For at teste denne hypotese fusionerede de et rationelt designet zinkbindingssted til et enzymstillads afledt af enzymet chorismatmutase.
"Vi var glade for at opdage, at fusionsproteinet udviste hidtil uset katalytisk promiskuitet," siger Gregg. "Det var i stand til at katalysere cycloadditionen af aziridiner med kuldioxid for at give oxazolidinoner - en reaktion, der hidtil ikke er blevet observeret i naturen."
Forskerne mener, at deres strategi også kan bruges til at udvide det katalytiske udvalg af andre enzymer. "Vi arbejder i øjeblikket på at udvide omfanget af vores kunstige metalloenzym til andre typer reaktioner," siger Erb. "Vi udforsker også brugen af andre metalioner og enzymstilladser."
Undersøgelsen, som blev offentliggjort i Nature Chemistry den 20. februar 2023, åbner op for nye muligheder for design af biokatalytiske processer. Ved at udvide det katalytiske udvalg af enzymer kan det være muligt at udvikle mere effektive og miljøvenlige metoder til fremstilling af en række forskellige kemikalier.
Sidste artikelVideo:Hvordan kemi kan forbedre billige varm kakao
Næste artikelKan brugt kaffegrums hjælpe med at rense miljøgifte?
 Varme artikler
Varme artikler
-
 Forskere opdager metode til at levere urtetilskud curcumin til kræftceller ved at løse dets uoplø…Holdet detaljerede en hierarkisk tilgang til at solubilisere et hydrofobt anti-cancer lægemiddel, curcumin i vand via en kombination af koordinationsdrevet selvsamling og vært-gæst interaktioner. Kred
Forskere opdager metode til at levere urtetilskud curcumin til kræftceller ved at løse dets uoplø…Holdet detaljerede en hierarkisk tilgang til at solubilisere et hydrofobt anti-cancer lægemiddel, curcumin i vand via en kombination af koordinationsdrevet selvsamling og vært-gæst interaktioner. Kred -
 Forskere opretter den første milliard-atom biomolekylære simuleringEt Los Alamos-ledet team skabte den hidtil største simulering af et helt DNA-gen, en bedrift, der krævede en milliard atomer for at modellere. Kredit:Los Alamos National Laboratory Forskere ved Lo
Forskere opretter den første milliard-atom biomolekylære simuleringEt Los Alamos-ledet team skabte den hidtil største simulering af et helt DNA-gen, en bedrift, der krævede en milliard atomer for at modellere. Kredit:Los Alamos National Laboratory Forskere ved Lo -
 Sikker udskrivning med vandbaseret usynligt blækForskere i Kina har udviklet en omskrivbar papirbelægning, der kan kryptere hemmelig information med relativt lavteknologisk usynligt blæk-vand. En besked, der udskrives af en vandstråleprinter på et
Sikker udskrivning med vandbaseret usynligt blækForskere i Kina har udviklet en omskrivbar papirbelægning, der kan kryptere hemmelig information med relativt lavteknologisk usynligt blæk-vand. En besked, der udskrives af en vandstråleprinter på et -
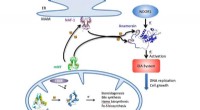 MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
MiNT -protein et nyt mål for at angribe sygdomEn illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metabol
- Hvor tæt er for en kilonova?
- EPA-reglen begrænser skarpt HFC'er, gasser brugt som kølemidler
- Afdelingskontorer:Ny familie af guldbaserede nanopartikler kunne tjene som biomedicinsk testbed
- Forskere kombinerer lasere og terahertz-bølger i kameraet, der ser usete detaljer
- Typer af vilde katte i Arizona
- Honningbiers behårede underliv viser, hvordan man sparer energi, reducere slid på materialer


