Forskere begynder at afsløre, hvordan proteinet tau overgår fra en opløselig flydende tilstand faste fibrøse sammenfiltringer
Her er en oversigt over de resultater, der har bidraget til vores forståelse af denne proces:
1. Faseovergange :Forskning tyder på, at tau kan gennemgå en faseovergang, der skifter fra en opløselig, dynamisk tilstand til en mere ordnet, fast-lignende tilstand. Denne overgang er påvirket af forskellige faktorer, herunder koncentrationen af tau, tilstedeværelsen af andre molekyler og det cellulære miljø.
2. Væske-væske faseadskillelse :Under visse forhold kan tau danne væskedråber i celler, en proces kendt som væske-væskefaseseparation. Disse dråber er dynamiske og kan gennemgå fusion og fission, hvilket muliggør udveksling af molekyler og potentielle interaktioner med andre cellulære komponenter.
3. Protein fejlfoldning og aggregation :Når tau overgår fra den flydende tilstand, kan den gennemgå fejlfoldning, hvilket fører til dannelsen af unormale strukturer. Disse forkert foldede tau-molekyler kan derefter aggregere og flette sig ind i hinanden og danne de karakteristiske sammenfiltringer. De nøjagtige mekanismer, der driver tau-fejlfoldning og aggregering, bliver stadig undersøgt.
4. Tau-ændringer :Post-translationelle modifikationer af tau, såsom phosphorylering, acetylering og glycosylering, kan påvirke dets opløselighed, aggregeringstilbøjelighed og interaktioner med andre proteiner. Disse modifikationer kan påvirke tau-faseovergangen og bidrage til dannelsen af patologiske tau-aggregater.
5. Cellular Pathways :Overgangen af tau fra en flydende til en fast tilstand er påvirket af cellulære veje og signalkaskader. Dysregulering af disse veje, såsom dem, der er involveret i proteinhomeostase og proteasomal nedbrydning, kan bidrage til akkumulering af tau-aggregater og udvikling af neurodegenerative sygdomme.
At forstå de mekanismer, der ligger til grund for tau-faseovergangen, er afgørende for at udvikle terapeutiske strategier til at målrette og forhindre dannelsen af tau-tangles. Ved at modulere tau-faseadfærden og gribe ind i de involverede molekylære veje, sigter forskerne på at afbøde de neurotoksiske virkninger af tau-aggregater og potentielt bremse udviklingen af neurodegenerative sygdomme.
 Varme artikler
Varme artikler
-
 Ny metode til mere præcis bestemmelse af dødstidspunkt på gerningsstederKredit:CC0 Public Domain Forskere fra Amsterdam UMC, universitetet i Amsterdam og det nederlandske retsmedicinske institut (NFI) - partnere i den retsmedicinske forskningsinstitution Co van Ledden
Ny metode til mere præcis bestemmelse af dødstidspunkt på gerningsstederKredit:CC0 Public Domain Forskere fra Amsterdam UMC, universitetet i Amsterdam og det nederlandske retsmedicinske institut (NFI) - partnere i den retsmedicinske forskningsinstitution Co van Ledden -
 Grafen øger perovskite-enkeltkrystal-fotodetektorens ydeevneKredit:CC0 Public Domain På grund af den brede anvendelse af fotodetektorer inden for områder, herunder optisk kommunikation, miljøovervågning, og billedsansning, forskning i udvikling af højeffek
Grafen øger perovskite-enkeltkrystal-fotodetektorens ydeevneKredit:CC0 Public Domain På grund af den brede anvendelse af fotodetektorer inden for områder, herunder optisk kommunikation, miljøovervågning, og billedsansning, forskning i udvikling af højeffek -
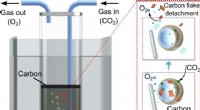 Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U
Flydende metal har vist sig at være en billig og effektiv CO2 -omformerUNSW -forskere har hjulpet med at vise, hvordan kuldioxid kan nedbrydes billigt og effektivt via en proces, der opløser fanget CO2 -gas i et opløsningsmiddel omkring nanopartikler af gallium. Kredit:U -
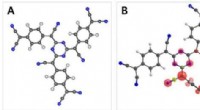 Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST
Organisk ferromagnetisme:Fældning spinder i den glasagtige tilstand af en organisk netværksstruktu…Et team af forskere, tilknyttet Sydkoreas Ulsan National Institute of Science and Technology (UNIST) præsenterer alternative metoder til alsidige fremtidige anvendelser af plastmagneter. Kredit:UNIST
- Er madbaseret plast en god idé?
- Sten viser, at Mars engang føltes som Island
- At betale for coronavirus skal være som krigsgæld – spredt over generationer
- Nanorør er pejlemærker i kræftbilleddannelsesteknik
- Elastiske dyser kunne skabe mere stabile væskestråler
- Forurenende stoffer fra naturbrande påvirker afgrøde- og vegetationsvæksten hundredvis af kilomet…


