Hvad sker der med størrelsen af atomer nede i gruppe 1?
Her er en tabel, der viser atomradierne for de første fem alkalimetaller:
| Element | Atomnummer | Atomradius (pm) |
|---|---|---|
| Lithium | 3 | 155 |
| Natrium | 11 | 190 |
| Kalium | 19 | 235 |
| Rubidium | 37 | 248 |
| Cæsium | 55 | 265 |
Som du kan se, stiger atomradius fra lithium til cæsium. Denne tendens er konsistent i hele gruppe 1 og er et resultat af det stigende antal energiniveauer, efterhånden som du bevæger dig ned i gruppen.
Sidste artikelHvad er den empiriske formel for forbindelse under C10H25O5?
Næste artikelHvad er atomnummeret for grafit?
 Varme artikler
Varme artikler
-
 Forskere udvikler en kunstig kloroplastPlantethylacoider er indkapslet i mikrodråber på cirka 90 mikrometer i diameter. Udstyret med et sæt enzymer, de semisyntetiske kloroplaster fikserer kuldioxid ved hjælp af solenergi, efter naturens e
Forskere udvikler en kunstig kloroplastPlantethylacoider er indkapslet i mikrodråber på cirka 90 mikrometer i diameter. Udstyret med et sæt enzymer, de semisyntetiske kloroplaster fikserer kuldioxid ved hjælp af solenergi, efter naturens e -
 Aldring af perovskite-løsning:Forskere finder en løsningDen rene stabilisator triethylborat bruges til at hæmme sidereaktioner i perovskit-opløsningen. Kredit:WANG Xiao Et forskerhold fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT
Aldring af perovskite-løsning:Forskere finder en løsningDen rene stabilisator triethylborat bruges til at hæmme sidereaktioner i perovskit-opløsningen. Kredit:WANG Xiao Et forskerhold fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT -
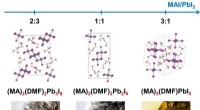 Forskere foreslår metode til at øge effektiviteten af solcellebatterierKrystalstrukturer af krystallinske solvater. Kredit:Alexey Tarasov Forskere fra Institut for Materialevidenskab, Lomonosov MSU, har bestemt, hvordan ændring af forholdet mellem komponenter, der da
Forskere foreslår metode til at øge effektiviteten af solcellebatterierKrystalstrukturer af krystallinske solvater. Kredit:Alexey Tarasov Forskere fra Institut for Materialevidenskab, Lomonosov MSU, har bestemt, hvordan ændring af forholdet mellem komponenter, der da -
 Enzymer fra svampe forenkler kemisk synteseKredit:Delft University of Technology Ved at bruge naturlige enzymer opnået fra svampe, forskere fra TU Delft har potentielt lavet syntesen af visse lægemidler, kosmetik og agrokemikalier meget
Enzymer fra svampe forenkler kemisk synteseKredit:Delft University of Technology Ved at bruge naturlige enzymer opnået fra svampe, forskere fra TU Delft har potentielt lavet syntesen af visse lægemidler, kosmetik og agrokemikalier meget


