Hvad er det samlede antal atomer i 14,5 g natriumacetat?
1. Beregn molmassen af natriumacetat:
- Molær masse af Na =22,99 g/mol
- Molær masse af C =12,01 g/mol
- Molær masse af H =1,008 g/mol
- Molær masse af O =16,00 g/mol
Molær masse af CH3COONa =(22,99 g/mol) + (3 x 12,01 g/mol) + (3 x 1,008 g/mol) + (3 x 16,00 g/mol)
=82,03 g/mol
2. Beregn antallet af mol i 14,5 g natriumacetat:
Antal mol =Masse / Molær masse
=14,5 g / 82,03 g/mol
=0,1767 mol
3. Bestem det samlede antal atomer:
Da der er et natriumatom, tre kulstofatomer, tre hydrogenatomer og tre oxygenatomer i hvert molekyle af natriumacetat, kan vi gange antallet af mol med det samlede antal atomer pr. molekyle.
Samlet antal atomer =(Antal mol) x (Totalt antal atomer pr. molekyle)
=0,1767 mol x (1 Na + 3 C + 3 H + 3 O)
=0,1767 mol x (1 + 3 + 3 + 3)
=0,1767 mol x 10
=1,767 x 10^23 atomer
Derfor er det samlede antal atomer i 14,5 g natriumacetat cirka 1,767 x 10^23 atomer.
Sidste artikelHvor mange oxygenatomer er der i en formelenhed af natriumacetat?
Næste artikelHvor mange atomer har NaC2H3O2?
 Varme artikler
Varme artikler
-
 Håndstrikkede molekylerMichael Calame leder Empas laboratorium Transport at Nanoscale Interfaces. Han designede og overvågede eksperimenterne sammen med Marcel Mayor fra universitetet i Basel og Jaime Ferrer fra universitet
Håndstrikkede molekylerMichael Calame leder Empas laboratorium Transport at Nanoscale Interfaces. Han designede og overvågede eksperimenterne sammen med Marcel Mayor fra universitetet i Basel og Jaime Ferrer fra universitet -
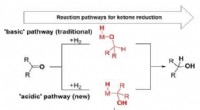 Metalhydrider med forbedret stabilitet i vandFigur viser de basiske og sure metalhydridveje for ketonreduktionsreaktionen. Alternative reaktionsveje for kendte reaktioner bidrager til forståelsen af katalytiske systemer, men giver også mulighe
Metalhydrider med forbedret stabilitet i vandFigur viser de basiske og sure metalhydridveje for ketonreduktionsreaktionen. Alternative reaktionsveje for kendte reaktioner bidrager til forståelsen af katalytiske systemer, men giver også mulighe -
 Singlet oxygens nøglerolle i synergistisk antimikrobiel mekanismeMønstre af intracellulær ROS (·OH, 1 O2 , H2 O2 , O2 - ) ændringer i gær. Kredit:Xu Hangbo Forskere ledet af prof. Huang Qing fra Hefei Institutes of Physical Science (HFIPS) under det kinesiske vi
Singlet oxygens nøglerolle i synergistisk antimikrobiel mekanismeMønstre af intracellulær ROS (·OH, 1 O2 , H2 O2 , O2 - ) ændringer i gær. Kredit:Xu Hangbo Forskere ledet af prof. Huang Qing fra Hefei Institutes of Physical Science (HFIPS) under det kinesiske vi -
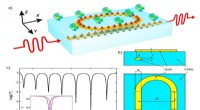 Blod og sved:Bærbare medicinske sensorer vil få et stort følsomhedsforøgelseBiosensor layout (en, c). Bølgelederen er inde i det dielektriske substrat. Resonatoren, realiseret som en ringbølgeleder, er placeret ved grænsefladen mellem det dielektriske materiale og den biologi
Blod og sved:Bærbare medicinske sensorer vil få et stort følsomhedsforøgelseBiosensor layout (en, c). Bølgelederen er inde i det dielektriske substrat. Resonatoren, realiseret som en ringbølgeleder, er placeret ved grænsefladen mellem det dielektriske materiale og den biologi
- Hvem skal betale for skader forbundet med klimaforandringer – og hvem skal kompenseres?
- Senegal lancerer afrikansk cybersikkerhedsskole
- Paleolake -aflejringer på Mars kan ligne sedimenter i Indonesien
- Bekymret for din Samsung Note 7? Her er muligheder
- Langsom strøm af menneskelig immigration kan have dømt neandertalere
- Hvad er studie af materialer?


