Hvorfor stiger opløseligheden på grund af temperaturen for faste stoffer?
Der er nogle få undtagelser fra denne regel. For eksempel falder opløseligheden af calciumsulfat med stigende temperatur. Det skyldes, at calciumsulfatmolekyler danner stærke bindinger med vandmolekyler, så jo højere temperatur, jo mere dissocierer calciumsulfatmolekylerne og jo mindre i stand til at opløses i vandet.
Tabellen nedenfor viser opløseligheden af nogle få almindelige faste stoffer i vand ved forskellige temperaturer.
| Solid | Opløselighed ved 0°C (g/100g H2O) | Opløselighed ved 100°C (g/100g H2O) |
|---|---|---|
| NaCl | 35,7 | 39,8 |
| CaSO4 | 2,06 | 0,228 |
| NaNO3 | 88 | 187 |
Sidste artikelBeskriv tre kemiske egenskaber ved en syre?
Næste artikelHvordan kan man fremstille 10ppm NaOH-opløsning?
 Varme artikler
Varme artikler
-
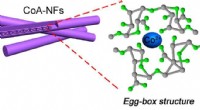 Tang:Fra superfood til superlederForskere har skabt porøse æggekasse-strukturerede nanofibre ved hjælp af tangekstrakt. Kredit:American Chemical Society Tang, de spiselige alger med en lang historie i nogle asiatiske køkkener, og
Tang:Fra superfood til superlederForskere har skabt porøse æggekasse-strukturerede nanofibre ved hjælp af tangekstrakt. Kredit:American Chemical Society Tang, de spiselige alger med en lang historie i nogle asiatiske køkkener, og -
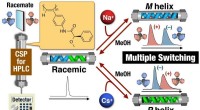 Multi-state omskiftelig stationær fase åbner nye døre i kiral adskillelseSkematisk illustration af tre-tilstands omskiftelig kiral stationær fase baseret på makromolekylær helicitetsmodulering i et poly (phenylacetylen) derivat ved hjælp af metalkationer i søjlen. Kredit:K
Multi-state omskiftelig stationær fase åbner nye døre i kiral adskillelseSkematisk illustration af tre-tilstands omskiftelig kiral stationær fase baseret på makromolekylær helicitetsmodulering i et poly (phenylacetylen) derivat ved hjælp af metalkationer i søjlen. Kredit:K -
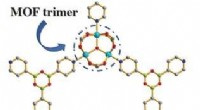 Meget resorptive metal-organiske rammerKredit:Angewandte Chemie International Edition Gasser og forurenende stoffer kan filtreres fra luft og væsker ved hjælp af porøse, krystallinske materialer, såsom metal-organiske rammer (MOFer). F
Meget resorptive metal-organiske rammerKredit:Angewandte Chemie International Edition Gasser og forurenende stoffer kan filtreres fra luft og væsker ved hjælp af porøse, krystallinske materialer, såsom metal-organiske rammer (MOFer). F -
 Molekyle flyvehastighed til påvisning af stofferKredit:CC0 Public Domain Tilstedeværelsen af cannabinoider i tekstilvarer og farmakologiske varer og behovet for at skelne dem fra dem, der findes i stoffer og psykotrope midler, har ført til ud
Molekyle flyvehastighed til påvisning af stofferKredit:CC0 Public Domain Tilstedeværelsen af cannabinoider i tekstilvarer og farmakologiske varer og behovet for at skelne dem fra dem, der findes i stoffer og psykotrope midler, har ført til ud
- Outback radioteleskop lytter til interstellar besøgende
- Symptomer alle i dit hoved - eller i din tarm? Måske lidt af begge dele.
- Forskel mellem hæmatit og neodymmagneter
- Et kig på klimaforårsagede skader, der udspiller sig i Perus Cordillera Blanca
- Frankrig på vej mod den tørreste juli nogensinde:vejrkontor
- At glide på fleksible grafenoverflader har været ukendt territorium indtil nu


