En 50 ml prøve af en 1,00 m opløsning cuso4 blandes med 2 m koh i kalorimeter temperaturen begge opløsninger var 20,2 C før blanding og 26,3 efter blanding?
I henhold til den givne tilstand:
$$T_1=20,2^0 C$$
$$T_2=26,3 ^0 C$$
$$C_{CuSO_4}=50\ ml$$
$$M_{CuSO_4} =1,00\ mol/ml$$
$$V_{KOH}=2\ M$$
Varmeændringen $$(\Delta H)$$ af reaktionen er givet som:
$$\Delta H =-C_pm_c\Delta T$$
Hvor:
$$C_p=specifik \ varme \ konstant\ af \ vand$$
Den specifikke varmekonstant for vand er $$4.184 J/g^0 C$$
$$m_c=masse\ af\ kalorimeter\ løsning$$
Densiteten af vand er $$1g/ml$$
Derfor massen af opløsningen=volumen$$=50+50=100g$$
Så $$m_c=100g$$
$$\Delta T=T_2-T_1=26.3-20.2=6.1 ^0C$$
Ved at erstatte disse værdier i ovenstående udtryk får vi
$$\Delta H=-(4.184\ J/g^0 C) \ (100g)( 6.1^0 C)$$
$$=-2567,94\ J$$
$$\derfor \Delta H=-2.57\ kJ$$
Derfor er reaktionsentalpien -2,57 kJ
Sidste artikelEr jern og klor en ionforbindelse?
Næste artikelHvorfor Amino og opløseligt i hydrochloridsyre?
 Varme artikler
Varme artikler
-
 Plastforurening:Kemisk genanvendelse kunne give en løsningKredit:Salvacampillo/Shutterstock Verden drukner i plastik. Omkring 60 % af de mere end 8, 700 millioner tons plastik, der nogensinde er fremstillet, er ikke længere i brug, i stedet sad mest på l
Plastforurening:Kemisk genanvendelse kunne give en løsningKredit:Salvacampillo/Shutterstock Verden drukner i plastik. Omkring 60 % af de mere end 8, 700 millioner tons plastik, der nogensinde er fremstillet, er ikke længere i brug, i stedet sad mest på l -
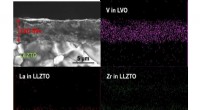 Katodefremstilling til oxid-solid-state-batterier ved stuetemperaturSEM-billede af en brudt tværsnitsoverflade af LVO-elektroden fremstillet på LLZTO-granat af AD. Tilsvarende elementær kortlægning for V, La, og Zr er også vist. Kredit:Toyohashi University of Technolo
Katodefremstilling til oxid-solid-state-batterier ved stuetemperaturSEM-billede af en brudt tværsnitsoverflade af LVO-elektroden fremstillet på LLZTO-granat af AD. Tilsvarende elementær kortlægning for V, La, og Zr er også vist. Kredit:Toyohashi University of Technolo -
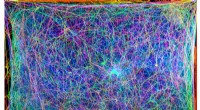 At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek
At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek -
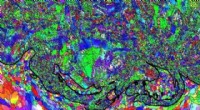 Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitetDen øverste del viser en koldspray kobber belægning, med meget synlige hvirvellignende strukturer, der snurrer rundt om et aluminiumsunderlag i bunddelen. Kredit:EBSD Et internationalt forskerteam
Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitetDen øverste del viser en koldspray kobber belægning, med meget synlige hvirvellignende strukturer, der snurrer rundt om et aluminiumsunderlag i bunddelen. Kredit:EBSD Et internationalt forskerteam
- Hvad har vi lært af Human Genome Project?
- Farveblindhed komplicerer racerelaterede samtaler mellem hvide forældre og børn
- Kernemagnetisk resonans:høj følsomhed på det mindste rum
- Kan sult udryddes inden 2030?
- Hvordan ændres oxidationstilstanden af Li i følgende reaktion?
- Videnskaben siger:Hvorfor nogle flyvemaskiner ikke flyver i høj varme


