Hvad er fysisk-kemiske egenskaber, som baserne har til fælles?
1. Smag og fornemmelse :Baser har ofte en bitter smag og føles glatte eller sæbeagtige at røre ved. For eksempel har natriumhydroxid, almindeligvis kendt som lud, en karakteristisk bitter smag og en glat tekstur, når det opløses i vand.
2. pH-niveau :Baser har en pH-værdi større end 7. pH-skalaen måler surhedsgraden eller alkaliniteten af et stof på en skala fra 0 til 14, med 7 som neutral. En pH-værdi over 7 indikerer en basisk opløsning.
3. Reaktion med syrer :Baser reagerer med syrer og danner salt og vand gennem en kemisk reaktion kendt som neutralisering. Når en base og en syre kombineres i passende mængder, bliver den resulterende opløsning neutral med en pH på 7.
4. Farve :Nogle baser har tydelige farver. For eksempel fremstår kobber(II)hydroxid lyseblåt, mens natriumhydroxid (lud) er farveløst, når det opløses i vand.
5. Ledningsevne :Baser er ligesom syrer elektrolytter. Det betyder, at de kan lede elektricitet, når de er opløst i vand eller i smeltet tilstand. De opløste basemolekyler adskilles i positivt ladede ioner (kationer) og negativt ladede ioner (anioner), hvilket tillader strømmen af elektrisk strøm.
6. Ætsende :Stærke baser kan være ætsende, hvilket betyder, at de kan beskadige levende væv og visse materialer ved kontakt. Koncentrerede baser kan forårsage forbrændinger og irritation af hud og øjne.
7. Dannelse af hydroxidioner :Når en base opløses i vand, gennemgår den en kemisk reaktion med vandmolekyler, hvilket resulterer i dannelsen af hydroxidioner (OH-) og den tilsvarende kation. Hydroxidionerne bidrager til opløsningens grundlæggende egenskaber.
8. Reaktivitet med metaller :Nogle stærke baser, såsom natriumhydroxid, kan reagere med visse metaller, såsom aluminium og zink, for at producere brintgas. Denne reaktion er karakteriseret ved udvikling af bobler og frigivelse af varme.
Det er vigtigt at bemærke, at selvom disse egenskaber generelt observeres blandt baser, kan der være undtagelser eller variationer i specifikke tilfælde afhængigt af basens art og styrke.
Sidste artikelSuser kvarts i saltsyre?
Næste artikelNår du går ned i gruppe 1, hvorfor får atomerne større tværsnit?
 Varme artikler
Varme artikler
-
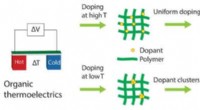 Sådan opfanges spildvarmeenergi med forbedrede polymererEt UMass Amherst-team af kemikere og elektriske ingeniører skitserer en ny måde at fremme en mere effektiv, billigere, polymer-baseret høst af varmeenergi til at producere elektricitet i et nyligt pap
Sådan opfanges spildvarmeenergi med forbedrede polymererEt UMass Amherst-team af kemikere og elektriske ingeniører skitserer en ny måde at fremme en mere effektiv, billigere, polymer-baseret høst af varmeenergi til at producere elektricitet i et nyligt pap -
 Forskere sætter AI i gang med at lave kemiforudsigelserKredit:Caltech Efterhånden som kemien er blevet mere avanceret og de kemiske reaktioner mere komplekse, det er ikke længere altid praktisk for forskere at sætte sig ved en laboratoriebænk og begyn
Forskere sætter AI i gang med at lave kemiforudsigelserKredit:Caltech Efterhånden som kemien er blevet mere avanceret og de kemiske reaktioner mere komplekse, det er ikke længere altid praktisk for forskere at sætte sig ved en laboratoriebænk og begyn -
 Kender du vejen til Berkelium, Californium?Forskere ved Berkeley Labs forgænger, UC Radiation Laboratory, opdagede berkelium i 1949, og californium i 1950. I dag, Berkeley Lab-forskere bruger avancerede instrumenter på Molecular Foundry for be
Kender du vejen til Berkelium, Californium?Forskere ved Berkeley Labs forgænger, UC Radiation Laboratory, opdagede berkelium i 1949, og californium i 1950. I dag, Berkeley Lab-forskere bruger avancerede instrumenter på Molecular Foundry for be -
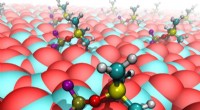 Videnskaben bag syltede batterielektrolytterHer er syltede elektrolytmolekyler (PF 2 OSiMe 3 ) binding til reaktionscentre på katodeoverfladen. For bold-og-stok-molekylerne, der er fastgjort til katodeoverfladen, olivengrøn angiver fosfor (
Videnskaben bag syltede batterielektrolytterHer er syltede elektrolytmolekyler (PF 2 OSiMe 3 ) binding til reaktionscentre på katodeoverfladen. For bold-og-stok-molekylerne, der er fastgjort til katodeoverfladen, olivengrøn angiver fosfor (
- DNA bliver vores hænder til at konstruere avancerede polyedriske nanopartikler
- Djævelen i defekte detaljer af kvanteemissioner optrevlet
- Simuleringer viser, at ekstreme meninger kan føre til polariserede grupper
- Lab eksperimenter med pulserede ionstråler afslører strålingsskadeprocesser i silicium
- NASAs første planetariske forsvarsmissionsmål får et nyt navn
- Modellering af polymerer til næste generations produktion og bæredygtighed


