Hvad gør noget til et syreantydning, hvad frigiver det i vand?
Et stof reagerer som en syre, hvis det:
- Afgiver brintioner, når de er opløst i vand
- Bliver blå lakmusrød
- Smager surt
- Reagerer med metaller som Zn og afgiver brændbar brintgas
Syrer frigiver hydrogenioner (H+) i vand. Dette skyldes vandmolekylernes polære natur. Iltatomet i vand har en delvis negativ ladning, mens brintatomet har en delvis positiv ladning. Denne polaritet gør det muligt for vandmolekyler at bryde syremolekyler fra hinanden, hvilket får dem til at frigive H+ ioner.
Styrken af en syre bestemmes af dens evne til at donere H+ ioner. Jo lettere en syre donerer H+ ioner, jo stærkere er den. Syrer klassificeres som stærke eller svage baseret på deres ioniseringsgrad i vand.
- Stærke syrer dissocierer fuldstændigt i vand og frigiver alle deres H+ ioner. Eksempler på stærke syrer omfatter saltsyre (HCl), svovlsyre (H2SO4) og salpetersyre (HNO3).
- Svage syrer dissocierer kun delvist i vand og frigiver kun en lille del af deres H+ ioner. Eksempler på svage syrer omfatter eddikesyre (CH3COOH), kulsyre (H2CO3) og phosphorsyre (H3PO4).
pH-skalaen bruges til at måle surheden eller basiciteten af en opløsning. pH-skalaen går fra 0 til 14, hvor 7 er neutral. Opløsninger med en pH-værdi under 7 er sure, mens opløsninger med en pH-værdi over 7 er basiske.
Sidste artikelHvad er nogle kendetegn ved flydende stof?
Næste artikelHvor produceres iltgas?
 Varme artikler
Varme artikler
-
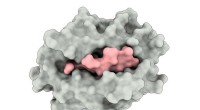 En gang nedsat bindingsmekanisme kan være nøglen til at målrette virusEn illustration viser et større histokompatibilitets (gråt) protein, der omfatter et peptid hentet fra et SARS-CoV-virus (pink). Komplekset hjælper med at udløse aktiveringen af T -celler, der er en
En gang nedsat bindingsmekanisme kan være nøglen til at målrette virusEn illustration viser et større histokompatibilitets (gråt) protein, der omfatter et peptid hentet fra et SARS-CoV-virus (pink). Komplekset hjælper med at udløse aktiveringen af T -celler, der er en -
 Forskere renser dramatisk op i ammoniakproduktionen og reducerer omkostningerneSWAP-processen i aktion. Den omdanner effektivt 90 procent af råmaterialet til ammoniak på én gang, hvorimod Haber-Bosch-processen kun konverterer 10 pct. Kredit:2019 Yoshiaki Nishibayashi Ammonia
Forskere renser dramatisk op i ammoniakproduktionen og reducerer omkostningerneSWAP-processen i aktion. Den omdanner effektivt 90 procent af råmaterialet til ammoniak på én gang, hvorimod Haber-Bosch-processen kun konverterer 10 pct. Kredit:2019 Yoshiaki Nishibayashi Ammonia -
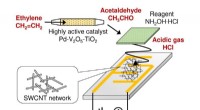 Udvikling af en lille sensor, der er i stand til løbende at overvåge phytohormon ethylenEn lille, meget følsom sensor, der er i stand til at detektere ethylen med stor selektivitet. Kredit:NIMS NIMS og AIST har udviklet en lille sensor, der er i stand til kontinuerligt at overvåge pl
Udvikling af en lille sensor, der er i stand til løbende at overvåge phytohormon ethylenEn lille, meget følsom sensor, der er i stand til at detektere ethylen med stor selektivitet. Kredit:NIMS NIMS og AIST har udviklet en lille sensor, der er i stand til kontinuerligt at overvåge pl -
 Forspændte puds til gamle bygningerEmpa-teamet har specielt designet U-formede stigbøjler lavet af CFRP til den nye metode (til venstre på billedet). Farverne angiver belastningen på materialet:gul betyder høj belastning; rød den stærk
Forspændte puds til gamle bygningerEmpa-teamet har specielt designet U-formede stigbøjler lavet af CFRP til den nye metode (til venstre på billedet). Farverne angiver belastningen på materialet:gul betyder høj belastning; rød den stærk
- Central Valley jordemissioner en stor kilde til stater nitrogenoxidforurening
- Ville det have været muligt at forudsige det newzealandske vulkanudbrud?
- Tiltagende nedbørsekstremiteter driver trævækstreduktioner på tværs af sydvest
- Atmosfærisk aerosoldannelse fra biogene dampe er stærkt påvirket af luftforurenende stoffer
- Nye metoder til at forhindre svig ved bestemmelse af hasselnødders geografiske oprindelse
- Hvis den kontraktile vakuole holder op med at virke, vil organismen dø, hvad sker der i cellen?


