Hvilken type binding har rent vand?
 Varme artikler
Varme artikler
-
 Bekæmpelse af de retsmedicinske ubekendte i 3D-trykte skydevåbenJames Cizdziel (højre), UM lektor i kemi og biokemi, og den seneste doktorgrad Oscar Beau Black har brugt to år på at undersøge 3D-printede skydevåben gennem et tilskud fra National Institute of Justi
Bekæmpelse af de retsmedicinske ubekendte i 3D-trykte skydevåbenJames Cizdziel (højre), UM lektor i kemi og biokemi, og den seneste doktorgrad Oscar Beau Black har brugt to år på at undersøge 3D-printede skydevåben gennem et tilskud fra National Institute of Justi -
 Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld
Retsmedicinsk kemiker foreslår svedteststrimmel som erstatning for alkometerUniversitetet i Albany retsmedicinsk kemiker Jan Halámek. Kredit:Paul Miller Retsmedicineren Jan Halámek har igen fundet en innovativ anvendelse til menneskelig sved - denne gang for at holde fuld -
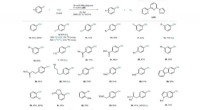 Katalytisk syntese af phenoler med dinitrogenoxidRevalorisering af N2 O som O-kilde i den katalytiske syntese af phenoler. Omfang af aryliodider. [N2 ], N2 detekteret af en gaskromatografi-termisk ledningsevnedetektor ved slutningen af reaktionen.
Katalytisk syntese af phenoler med dinitrogenoxidRevalorisering af N2 O som O-kilde i den katalytiske syntese af phenoler. Omfang af aryliodider. [N2 ], N2 detekteret af en gaskromatografi-termisk ledningsevnedetektor ved slutningen af reaktionen. -
 Observation af quasi-ligevægtsfase-sameksistens i superkritiske væskerPartikeltransport på dråbeoverfladen suspenderet i en superkritisk væske opnås ikke af individuelle atomare enheder, men ved klynger af nanometerstore partikler. Kredit:POSTECH En langvarig ikke-l
Observation af quasi-ligevægtsfase-sameksistens i superkritiske væskerPartikeltransport på dråbeoverfladen suspenderet i en superkritisk væske opnås ikke af individuelle atomare enheder, men ved klynger af nanometerstore partikler. Kredit:POSTECH En langvarig ikke-l
- Undersøgelse:Opvarmning gør den amerikanske vestlige megatørke værst i moderne tid
- Se et kort i realtid over Starlink-satellitter, der kredser om Jorden
- Hvilken type egenskaber er lettere at genkende fysisk eller kemisk?
- Nye nanostrukturer til effektiv langtrækkende energitransport
- Nyligt transskriberet krønike beskriver ekstreme vejrhændelser, der ramte Bristol for 400 år side…
- Undersøgelse afslører vigtige faktorer, der bestemmer eruptiv karakter af store soludbrud


