Hvad omkring huset vil neutralisere svovlsyre?
Bagepulver er en almindelig dagligvare, der effektivt kan neutralisere svovlsyre. Når bagepulver (NaHCO3) blandes med svovlsyre (H2SO4), gennemgår den en kemisk reaktion for at danne natriumsulfat (Na2SO4), vand (H2O) og kuldioxidgas (CO2).
Reaktionen kan repræsenteres som følger:
NaHC03 + H2SO4 → Na2SO4 + H2O + CO2
Bemærk: Tilsæt altid bagepulver til syren langsomt og forsigtigt, da reaktionen kan frigive en stor mængde kuldioxidgas, hvilket potentielt kan forårsage trykopbygning.
Ammoniak (NH3):
Husholdnings ammoniak, typisk fundet som en koncentreret opløsning, kan også neutralisere svovlsyre. Ammoniak er en base og reagerer med svovlsyre, en stærk syre, og danner ammoniumsulfat ((NH4)2SO4) og vand (H2O).
Reaktionen kan repræsenteres som følger:
2NH3 + H2SO4 → (NH4)2S04 + 2H2O
Forsigtig :Blanding af ammoniak med svovlsyre bør ske med ekstrem forsigtighed, da reaktionen kan frigive varme og dampe. Sørg for korrekt ventilation og følg sikkerhedsretningslinjerne, når du arbejder med ammoniak.
Kalk (Calciumhydroxid):
Kalk, almindeligvis tilgængelig som calciumhydroxid (Ca(OH)2), er et andet stof, der kan neutralisere svovlsyre. Når kalk tilsættes svovlsyre, reagerer den og danner calciumsulfat (CaSO4) og vand (H2O).
Reaktionen kan repræsenteres som følger:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Forsigtig: Tilsætning af kalk til svovlsyre kan generere en masse varme, så det er afgørende at følge passende sikkerhedsforanstaltninger, såsom at bære beskyttelsestøj og øjenudstyr, og udføre reaktionen i et godt ventileret område.
Husk, at når du har at gøre med svovlsyre, er sikkerhed af største vigtighed. Svovlsyre er stærkt ætsende og kan forårsage alvorlige forbrændinger og skader. Bær altid passende personlige værnemidler, herunder handsker, sikkerhedsbriller og en laboratoriefrakke eller forklæde. Udfør eventuelle syreneutraliseringsreaktioner i et kontrolleret og godt ventileret miljø, og følg alle sikkerhedsretningslinjer.
Sidste artikelHvordan dannes svovldioxid?
Næste artikelHvad er vands atommolekyle?
 Varme artikler
Varme artikler
-
 Et bionisk blad kunne hjælpe med at brødføde verdenRadiserne til højre blev dyrket ved hjælp af et bionisk blad, der producerer gødning med bakterier, sollys, vand og luft. Kredit:Nocera lab, Harvard Universitet I anden halvdel af det 20. århundre
Et bionisk blad kunne hjælpe med at brødføde verdenRadiserne til højre blev dyrket ved hjælp af et bionisk blad, der producerer gødning med bakterier, sollys, vand og luft. Kredit:Nocera lab, Harvard Universitet I anden halvdel af det 20. århundre -
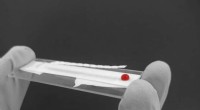 Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti
Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti -
 Ny teknik kaster lys over mysterierne bag komplekse kemiske reaktionsnetværkKredit:CC0 Public Domain Forskere ved det amerikanske energiministeriums Ames Laboratory og deres kolleger har opdaget en måde at opklare mysterierne bag komplekse reaktionsnetværk ved at anvende
Ny teknik kaster lys over mysterierne bag komplekse kemiske reaktionsnetværkKredit:CC0 Public Domain Forskere ved det amerikanske energiministeriums Ames Laboratory og deres kolleger har opdaget en måde at opklare mysterierne bag komplekse reaktionsnetværk ved at anvende -
 Ny nervegasdetektor bygget med lego og en smartphoneLavet af legoklodser og en smartphone, en enhed er forbundet til gratis software og bruger telefonens kamera til at identificere og detektere nervestoffer, som VX og sarin. Kredit:University of Texas
Ny nervegasdetektor bygget med lego og en smartphoneLavet af legoklodser og en smartphone, en enhed er forbundet til gratis software og bruger telefonens kamera til at identificere og detektere nervestoffer, som VX og sarin. Kredit:University of Texas
- Reaktion på brand påvirker vandstanden 40 år ud i fremtiden
- Hvad sker der i en Lewis-syrebase-reaktion?
- Bakteriebaserede biohybride mikrorobotter på en mission for en dag at bekæmpe kræft
- Hvad din far gjorde, før du blev født, kunne påvirke fremtiden
- Ulemper og fordele ved en HPLC
- Opklaring af et mysterium omkring kosmisk stof


