En 1,0 mol prøve af gas er indeholdt i en 2,0L beholder ved 1000 K Hvad trykket udøves af denne gas?
$$PV =nRT$$
hvor P er trykket, V er volumenet, n er antallet af mol gas, R er den ideelle gaskonstant, og T er temperaturen.
I dette tilfælde har vi n =1,0 mol, V =2,0 L, R =0,08206 L·atm/mol·K og T =1000 K. Ved at indsætte disse værdier i den ideelle gaslov får vi:
$$P =\frac{nRT}{V} =\frac{(1,0 mol)(0,08206 L·atm/mol·K)(1000 K)}{2,0 L} =41,03 atm$$
Derfor er trykket, som gassen udøver, 41,03 atm.
 Varme artikler
Varme artikler
-
 Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et
Ny indsigt i nanokrystalvækst i væskeGlimmer mineralet flager af i fine plader. Kredit:Wikimedia Commons Mange muslingeskaller, mineraler, og halvleder nanomaterialer er opbygget af mindre krystaller, som er samlet som brikkerne i et -
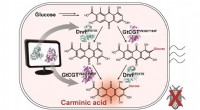 Mikrobiel produktion af et naturligt rødt farvestof karminsyreEn skematisk biosyntesevej til produktion af karminsyre fra glucose. Biokemisk reaktionsanalyse og computersimuleringsassisteret enzymteknik blev brugt til at identificere og forbedre enzymerne (DnrFP
Mikrobiel produktion af et naturligt rødt farvestof karminsyreEn skematisk biosyntesevej til produktion af karminsyre fra glucose. Biokemisk reaktionsanalyse og computersimuleringsassisteret enzymteknik blev brugt til at identificere og forbedre enzymerne (DnrFP -
 Ny antimikrobiel belægning kan være nøglen i kampen mod hospitalserhvervede infektionerKredit:CC0 Public Domain Forskere ved University of Birmingham har skabt en antimikrobiel belægning til ståloverflader, som har vist sig hurtigt at dræbe bakterier, der forårsager nogle af de mest
Ny antimikrobiel belægning kan være nøglen i kampen mod hospitalserhvervede infektionerKredit:CC0 Public Domain Forskere ved University of Birmingham har skabt en antimikrobiel belægning til ståloverflader, som har vist sig hurtigt at dræbe bakterier, der forårsager nogle af de mest -
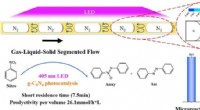 Forskere foreslår en ny metode til at forbedre heterogen fotosyntese af azoforbindelserKredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.130226 Fotokatalytiske reaktioner, som låser op for kemiske transformationer under milde forhold, der ikke er tilgængelige for
Forskere foreslår en ny metode til at forbedre heterogen fotosyntese af azoforbindelserKredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.130226 Fotokatalytiske reaktioner, som låser op for kemiske transformationer under milde forhold, der ikke er tilgængelige for
- Hvad er Lewis-strukturen af CH3COH?
- Guldforbindelse skifter fra en synlig fluorescens til at udsende infrarød, når den jordes
- Ocean Health Index udgiver den syvende årlige vurdering af global havsundhed
- Sådan laver du en 3-D Fish Model
- Studiet udforsker tætheden af de tektoniske plader, og hvorfor de synker i jordens kappe
- Sådan gør du fraktioner med en TI


