Beregn mængden af ammoniak produceret fra 50g N i ligning N2+3H2=2NH3?
Mol nitrogen (N) =masse/mol masse
=50g/14g/mol
=3,57 mol N
Lad os nu analysere støkiometrien af den afbalancerede kemiske ligning:
1 mol N2 reagerer med 3 mol H2 og producerer 2 mol NH3.
For at bestemme den begrænsende reaktant skal vi sammenligne molforholdet mellem N og H2 i ligningen med det tilgængelige molforhold mellem N og H2.
Hvis vi antager, at vi har en overskydende mængde brint (H2), så lad os beregne, hvor mange mol NH3, der kan produceres fra 3,57 mol N.
Fra den balancerede ligning:
2 mol NH3 fremstilles af 1 mol N2.
Så 3,57 mol N vil producere (2/1) * 3,57 mol NH3
=7,14 mol NH3
Nu skal vi konvertere mol NH3 tilbage til gram for at bestemme den producerede mængde. Den molære masse af NH3 er 17g/mol.
Masse af produceret NH3 =Mol af NH3 * Molær masse af NH3
=7,14 mol * 17 g/mol
=121,38 g NH3
Derfor kan 50 g nitrogen (N) producere cirka 121,38 g ammoniak (NH3).
Sidste artikelHvad er de forskellige typer af metalbelægningstjenester?
Næste artikelHvilket indeholder flere atomer 56g Fe eller 16g S?
 Varme artikler
Varme artikler
-
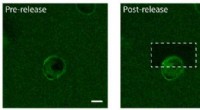 Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknikFotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen b
Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknikFotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen b -
 Et strejf salt kan styrke MXene -supermaterialer mod oxidationVed at kombinere et almindeligt føde- og vandadditiv, pholyphosphatsalte, med MXene materialer, forskere på Drexel har opdaget en måde at bremse oxidationsprocessen på, når de udsættes for vand. Kredi
Et strejf salt kan styrke MXene -supermaterialer mod oxidationVed at kombinere et almindeligt føde- og vandadditiv, pholyphosphatsalte, med MXene materialer, forskere på Drexel har opdaget en måde at bremse oxidationsprocessen på, når de udsættes for vand. Kredi -
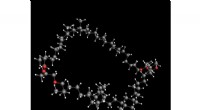 Syntese af et af de mest rigelige organiske lipider belyser dets strukturEn 3D-gengivelse af strukturen af crenarchaeol. Kredit:Adri Minnaard, Universitetet i Groningen Crenarchaeol er en stor, lipid med lukket kredsløb, der er til stede i membranerne af ammoniumoxid
Syntese af et af de mest rigelige organiske lipider belyser dets strukturEn 3D-gengivelse af strukturen af crenarchaeol. Kredit:Adri Minnaard, Universitetet i Groningen Crenarchaeol er en stor, lipid med lukket kredsløb, der er til stede i membranerne af ammoniumoxid -
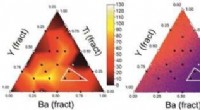 Opdager nye leads til funktionelle materialer styret af kunstig intelligensKredit:Wiley Søger efter blymaterialer med specifikke egenskaber, forskere har udviklet en arbejdsgang, der inkorporerer kunstig intelligens til at guide opdagelsen af en ny keramisk struktur me
Opdager nye leads til funktionelle materialer styret af kunstig intelligensKredit:Wiley Søger efter blymaterialer med specifikke egenskaber, forskere har udviklet en arbejdsgang, der inkorporerer kunstig intelligens til at guide opdagelsen af en ny keramisk struktur me
- Otte grunde til ikke at blive skræmt af edderkopper denne Halloween
- Orkanen Ida rammer Louisiana som kategori 4-storm
- Hvorfor Snapchat og WhatsApp bringer nye funktioner til beskeder
- Beskrivelse af de fire typer akvatiske økosystemer
- Båndbredde til allestedsnærværende 5G og mere kan være lige rundt om hjørnet med dette nye mikr…
- Hvad er geoder, og hvor kan du finde dem?


