30,4 gram X2O3 gas giver 2 atm tryk ved 273 C i en 8,96 liters beholder. Så hvor mange g.mol er den molære masse X-atom (O:16)?
PV =nRT
hvor P er trykket, V er volumenet, n er antallet af mol, R er gaskonstanten, og T er temperaturen.
Vi kan omarrangere ligningen for at løse for n:
n =PV/RT
Ved at indsætte de givne værdier i ligningen får vi:
n =(2 atm)(8,96 L)/(0,08206 L*atm/mol*K)(273 K)
n =0,118 mol
Antallet af mol X2O3-gas er lig med halvdelen af antallet af mol X-atomer, så molmassen af X-atom er:
Molær masse af X =(30,4 g)/(2 * 0,118 mol)
Molær masse af X =128 g/mol
Derfor er den molære masse af X-atom 128 g/mol.
 Varme artikler
Varme artikler
-
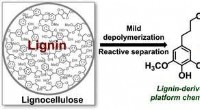 Gør træ til farmaceutiske ingredienserKredit:American Chemical Society Produktion af farligt affald under lægemiddelfremstilling er en alvorlig bekymring for medicinalindustrien. Typisk, store mængder brandfarlige opløsningsmidler anv
Gør træ til farmaceutiske ingredienserKredit:American Chemical Society Produktion af farligt affald under lægemiddelfremstilling er en alvorlig bekymring for medicinalindustrien. Typisk, store mængder brandfarlige opløsningsmidler anv -
 Krympefilm får grebKredit:American Chemical Society Mange mennesker husker med glæde at lege med legetøj kendt som Shrinky Dinks - plader af polystyrenplast med former, som børn kan farve, skær ud og varm i en ovn,
Krympefilm får grebKredit:American Chemical Society Mange mennesker husker med glæde at lege med legetøj kendt som Shrinky Dinks - plader af polystyrenplast med former, som børn kan farve, skær ud og varm i en ovn, -
 Konvertering af sollys til brændstof:Udvikling af mere effektive fotokatoderGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c04301 Fotoelektrokemiske celler er lovende værktøjer til omdannelse af sollys til brændstof, for eksempe
Konvertering af sollys til brændstof:Udvikling af mere effektive fotokatoderGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c04301 Fotoelektrokemiske celler er lovende værktøjer til omdannelse af sollys til brændstof, for eksempe -
 Nedbrydelige sukkerbaserede polymerer kan lagre og frigive nyttig molekylær fragtKredit:CC0 Public Domain Nedbrydeligt, biobaserede polymerer tilbyder muligheder for kemisk genbrug, og de kan være et redskab til at lagre og frigive nyttige molekyler. Forskere har udviklet en k
Nedbrydelige sukkerbaserede polymerer kan lagre og frigive nyttig molekylær fragtKredit:CC0 Public Domain Nedbrydeligt, biobaserede polymerer tilbyder muligheder for kemisk genbrug, og de kan være et redskab til at lagre og frigive nyttige molekyler. Forskere har udviklet en k
- Bevaringsbiolog siger, at tiden til at handle for Amazonas er nu
- Kan videospil hjælpe med at booste krydstogtreservationer?
- En farverig, bæredygtig løsning til 3D -print
- Team udvikler in vivo fleksible storskala integrerede kredsløb (m/ video)
- Hvem har ansvaret, når klimaforandringerne skader verdens fattigste lande, og hvordan ser kompensat…
- Honey Bee Information til børn


