Hvad er atomnummer og hvilke relationer har det til det periodiske system?
Et grundstofs atomnummer har flere vigtige relationer til det periodiske system:
1. Elementidentifikation :Atomnummeret er den definerende egenskab for et grundstof. Hvert grundstof har et unikt atomnummer, som adskiller det fra alle andre grundstoffer.
2. Periodiske tendenser :Atomnummeret er direkte relateret til de periodiske tendenser observeret i det periodiske system. Når atomnummeret stiger, viser visse egenskaber, såsom atomstørrelse, ioniseringsenergi og elektronegativitet, systematiske ændringer på tværs af perioder og grupper.
3. Elektronkonfiguration :Atomnummeret bestemmer elektronkonfigurationen af et grundstof. Antallet af protoner i kernen bestemmer antallet af elektroner, der kredser om kernen i neutrale atomer. Elektronkonfigurationen påvirker igen grundstoffets kemiske egenskaber.
4. Gruppenummerering :Det periodiske system er organiseret i nummererede grupper (1-18) baseret på det sidste ciffer i atomnummeret. Grundstoffer i samme gruppe deler lignende kemiske egenskaber, fordi de har det samme antal valenselektroner.
5. Periodenummerering :Det periodiske system er også opdelt i nummererede perioder (1-7) baseret på antallet af elektronskaller i atomet. Periodetallet svarer til det højeste energiniveau optaget af elektroner.
6. Kemisk binding :Atomnummeret påvirker grundstoffets kemiske bindingsadfærd. Grundstoffer med lignende atomnumre har en tendens til at have lignende kemiske egenskaber og deltager i lignende typer kemiske reaktioner.
At forstå atomnummeret og dets relationer til det periodiske system er afgørende for at organisere og forstå de forskellige kemiske grundstoffer og deres egenskaber. Det giver en ramme for at studere og forudsige grundstoffers adfærd og danner grundlag for at klassificere elementer i grupper og perioder, hvilket letter det systematiske studie af kemi.
Sidste artikelHvad er Lewis-strukturen af CH3COH?
Næste artikelVar der andre lavet af metal end kobber?
 Varme artikler
Varme artikler
-
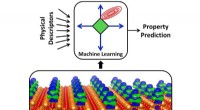 Undersøgelse viser, at maskinlæring kan forbedre katalytisk designEn kvantekemisk simulering (nederste panel) viser ladningsoverførslen (blå/grøn) mellem metalatomer og en underliggende støtte (orange). Dette er kun én beskrivelse af en katalysators fysiske adfærd,
Undersøgelse viser, at maskinlæring kan forbedre katalytisk designEn kvantekemisk simulering (nederste panel) viser ladningsoverførslen (blå/grøn) mellem metalatomer og en underliggende støtte (orange). Dette er kun én beskrivelse af en katalysators fysiske adfærd, -
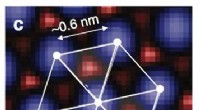 Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi -
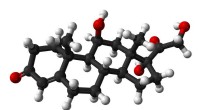 Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc
Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc -
 Dansende stof:Ny form for bevægelse af cykliske makromolekyler opdagetTil venstre:Øjebliksbillede af en ringpolymer ved oppustningsfasen i kraftig forskydning, ses som en projektion ind i flow-vorticity-planet. De stiplede blå linjer markerer polymerens massemiddelakser
Dansende stof:Ny form for bevægelse af cykliske makromolekyler opdagetTil venstre:Øjebliksbillede af en ringpolymer ved oppustningsfasen i kraftig forskydning, ses som en projektion ind i flow-vorticity-planet. De stiplede blå linjer markerer polymerens massemiddelakser
- Et trådløst plaster til overvågning af skadestuepatienter
- Sidste vinter Detroit autoshow en skygge af sit tidligere jeg
- Videnskabsprojekter om Newtons anden lov om bevægelse
- Spotify siger, at de vil springe over politiske annoncer i 2020
- Hvad er nogle eksempler på en fortyndet opløsning?
- Billede:Energiministeriets mission lanceret fra Wallops


