Hvorfor er nitrogen tungtopløseligt i vand?
1. Ikke-polær natur: Nitrogen er et ikke-polært molekyle, hvilket betyder, at det mangler en betydelig elektrisk ladning. Vand er på den anden side et polært molekyle med en delvis positiv ladning på brintatomerne og en delvis negativ ladning på iltatomet. Ikke-polære molekyler interagerer generelt ikke stærkt med polære molekyler, hvilket fører til begrænset opløselighed.
2. Stærke intermolekylære kræfter: Nitrogenmolekyler har stærke intermolekylære kræfter kendt som van der Waals-kræfter. Disse kræfter opstår fra tiltrækningen mellem de svagt positive og negative regioner af nabomolekyler. Styrken af disse kræfter mellem nitrogenmolekyler holder dem tæt pakket sammen, hvilket reducerer vandmolekylers evne til at trænge ind og opløse nitrogengas.
3. Lav polariserbarhed: Polariserbarhed refererer til et molekyles evne til at forvride sin elektronsky som reaktion på et elektrisk felt. Nitrogenmolekyler har lav polariserbarhed, hvilket betyder, at de ikke let deformeres eller forvrænges af vandmolekylers elektriske felt. Dette svækker yderligere interaktionerne mellem nitrogen og vand, hvilket resulterer i reduceret opløselighed.
4. Højt kogepunkt: Nitrogen har et relativt højt kogepunkt (-195,8°C) sammenlignet med andre gasser som oxygen og kuldioxid. Et stofs kogepunkt er en indikator for styrken af dets intermolekylære kræfter. Det højere kogepunkt for nitrogen tyder på stærkere intermolekylære kræfter, som gør det mindre sandsynligt, at det opløses i vand.
5. Hydreringsenergi: Hydrationsenergi refererer til den energi, der frigives, når ioner eller polære molekyler interagerer med vandmolekyler og bliver omgivet af en hydreringsskal. Nitrogen, som er et ikke-polært molekyle, gennemgår ikke væsentlig hydrering. Manglen på gunstige hydreringsinteraktioner bidrager yderligere til dens lave opløselighed i vand.
I modsætning til nitrogen er gasser som oxygen og kuldioxid mere opløselige i vand på grund af deres højere polaritet, svagere intermolekylære kræfter, lavere kogepunkter og mere gunstige hydreringsinteraktioner.
Sidste artikelVirker eddikebomber med bagepulver?
Næste artikelHvad er formlerne for et svovlatom, to hydrogenatomer og oxygenatomer?
 Varme artikler
Varme artikler
-
 Forsker ser på fremtiden for knogleudskiftningerHossein Montazerian, forskningsassistent ved UBC Okanagans School of Engineering, demonstrerer det kunstige knogledesign, der kan laves med en 3-D printer. Kredit:UBC Okanagan En UBC Okanagan-fors
Forsker ser på fremtiden for knogleudskiftningerHossein Montazerian, forskningsassistent ved UBC Okanagans School of Engineering, demonstrerer det kunstige knogledesign, der kan laves med en 3-D printer. Kredit:UBC Okanagan En UBC Okanagan-fors -
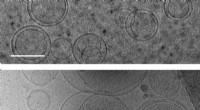 De første celler kan være opstået, fordi byggesten af proteiner stabiliserede membranerBilleder af membraner (cirkler) taget ved hjælp af transmissionselektronkryomikroskopi. Øverst:membraner i en opløsning, der ikke indeholder aminosyrer. Nederst:membraner i en opløsning indeholdende s
De første celler kan være opstået, fordi byggesten af proteiner stabiliserede membranerBilleder af membraner (cirkler) taget ved hjælp af transmissionselektronkryomikroskopi. Øverst:membraner i en opløsning, der ikke indeholder aminosyrer. Nederst:membraner i en opløsning indeholdende s -
 Forskere finder potentiale i miljøvenlig synthesizerDisse rombeformede partikler scanner elektronmikrofotografier af en organisk metalramme, kaldet ZIF-8, syntetiseret i superkritisk kuldioxid (scCO2). PNNL -forskere har rapporteret, at scCO2, et vigti
Forskere finder potentiale i miljøvenlig synthesizerDisse rombeformede partikler scanner elektronmikrofotografier af en organisk metalramme, kaldet ZIF-8, syntetiseret i superkritisk kuldioxid (scCO2). PNNL -forskere har rapporteret, at scCO2, et vigti -
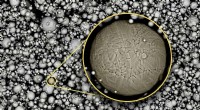 Forskere afslører kunsten at trykke ekstremt hårdt stål fejlfritMartensit stålpulver brugt til 3D-print. Indsat viser en zoomet visning af stålpulveret. Kredit:Raiyan Seede/Texas A&M University College of Engineering I årtusinder, metallurger har omhyggeligt j
Forskere afslører kunsten at trykke ekstremt hårdt stål fejlfritMartensit stålpulver brugt til 3D-print. Indsat viser en zoomet visning af stålpulveret. Kredit:Raiyan Seede/Texas A&M University College of Engineering I årtusinder, metallurger har omhyggeligt j
- Svampene blandt er de store nedbrydere
- Hvad får unge mennesker til at begå hadforbrydelser
- Rige lande kommer til kort inden for videnskab ligestilling mellem kønnene:UNESCO
- Forbrugere stoler mindre på influencers, når der er en række valgmuligheder for et produkt
- Kan videnskabsmænd bruge genredigering til sygdomsforebyggelse, men ikke menneskelig forbedring?
- COVID tvang australske fædre til at gøre mere derhjemme, men til samme pris har mødre længe hold…


