Hvad er pH-værdien af en 0,067 M vandig opløsning af natriumpropionat NaC3H5O2?
1. Skriv den afbalancerede kemiske ligning for dissociationen af natriumpropionat i vand:
NaC3H5O2(aq) → Na+(aq) + C3H5O2-(aq)
2. Propionationen (C3H5O2-) er en svag base og vil undergå hydrolyse i vand, hvilket producerer hydroxidioner (OH-) og øger opløsningens pH. Reaktionen for hydrolyse af propionation er:
C3H5O2-(aq) + H2O(l) ⇌ HC3H5O2(aq) + OH-(aq)
3. Ligevægtskonstanten for hydrolysen af propionation er givet ved basedissociationskonstanten (Kb) for propionsyre (HC3H5O2):
Kb =[HC3H5O2][OH-]/[C3H5O2-]
4. Værdien af Kb for propionsyre er 1,34 × 10^-5 ved 25°C.
5. Forudsat at hydrolysen af propionation er ubetydelig (hvilket er en rimelig antagelse for en 0,067 M opløsning), kan koncentrationen af hydroxidioner produceret ved hydrolyse beregnes ved hjælp af Kb-udtrykket:
[OH-] =Kb[C3H5O2-]/[HC3H5O2] ≈ Kb[C3H5O2-]
6. Ved at erstatte værdien af Kb og koncentrationen af propionation i ligningen ovenfor, får vi:
[OH-] ≈ (1,34 × 10^-5) (0,067) ≈ 9,0 × 10^-7 M
7. Til sidst kan vi beregne opløsningens pH ved hjælp af følgende ligning:
pH =-log[H3O+] =-log(Kw/[OH-])
hvor Kw er ionproduktkonstanten for vand (Kw =1,0 × 10^-14 ved 25°C).
8. Ved at erstatte værdien af [OH-] i ligningen ovenfor får vi:
pH =-log(1,0 × 10^-14/9,0 × 10^-7) ≈ 8,75
Derfor er pH-værdien af en 0,067 M vandig opløsning af natriumpropionat ca. 8,75.
Sidste artikelHvad er forskellen mellem carbon 4 oxid og dioxid?
Næste artikelHvordan laver man en neutral 8M kaliumfluoridopløsning?
 Varme artikler
Varme artikler
-
 Registrering af giftig PFAS med en sensor i chipstørrelseEn illustration af PNNLs PFAS -sensor. Vandprøver strømmer i den ene ende, gennem labyrinten, og PFOS bliver fanget af et svampelignende materiale i midten. Teknologien er tilgængelig for licensudsted
Registrering af giftig PFAS med en sensor i chipstørrelseEn illustration af PNNLs PFAS -sensor. Vandprøver strømmer i den ene ende, gennem labyrinten, og PFOS bliver fanget af et svampelignende materiale i midten. Teknologien er tilgængelig for licensudsted -
 Frigørelse af svovls kraft i fremtidigt lægemiddeldesignKredit:UTSA Organiske svovlforbindelser er udbredt til stede i vores kroppe og det naturlige miljø. De findes i løg, skalotteløg og endda blomkål. Medicinsk forskning viser, at når det indtages, d
Frigørelse af svovls kraft i fremtidigt lægemiddeldesignKredit:UTSA Organiske svovlforbindelser er udbredt til stede i vores kroppe og det naturlige miljø. De findes i løg, skalotteløg og endda blomkål. Medicinsk forskning viser, at når det indtages, d -
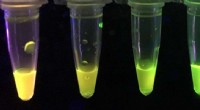 Kemikere udvikler papirbaserede sensorer til at detektere potente nervetoksinerEn ny sensor udviklet af U af A-kemikere bliver gul eller grøn under ultraviolet lys afhængigt af hvor meget parathion eller paraoxon der er til stede i en prøve. Kredit:Chris Robidillo En ny, pap
Kemikere udvikler papirbaserede sensorer til at detektere potente nervetoksinerEn ny sensor udviklet af U af A-kemikere bliver gul eller grøn under ultraviolet lys afhængigt af hvor meget parathion eller paraoxon der er til stede i en prøve. Kredit:Chris Robidillo En ny, pap -
 Et periodisk system med molekylære knuderHvilke nye knudetyper vil det være muligt at realisere i fremtiden? Dette er det udfordrende spørgsmål, som SISSA -forskere, i samarbejde med University of Padua, har tacklet ved hjælp af computersimu
Et periodisk system med molekylære knuderHvilke nye knudetyper vil det være muligt at realisere i fremtiden? Dette er det udfordrende spørgsmål, som SISSA -forskere, i samarbejde med University of Padua, har tacklet ved hjælp af computersimu
- Supercomputing dynamiske jordskælvsbrudmodeller
- Hvordan reagerer celler på mikro- og nanoplast?
- Kemi fakta
- Uforgængelig virus giver hemmelighed ved at skabe utroligt holdbare materialer
- Hvad består kovalente forbindelser normalt af?
- Netflix er i en battle royale med Fortnite i kampen om din skærmtid


