Hvad er forskellen mellem carbon 4 oxid og dioxid?
1. Kemisk formel:
- Kulilte:CO
- Kuldioxid:CO2
2. Antal iltatomer:
- Kulilte består af ét kulstofatom bundet til ét oxygenatom.
- Kuldioxid består af et kulstofatom bundet til to oxygenatomer.
3. Molekylær struktur:
- Kulilte har en lineær molekylær struktur med kulstof- og oxygenatomerne forbundet med en tredobbeltbinding.
- Kuldioxid har en lineær molekylær struktur med kulstofatomet bundet til de to oxygenatomer gennem dobbeltbindinger.
4. Egenskaber:
- Kulilte er en farveløs, lugtfri og giftig gas. Det er lettere end luft og lidt opløseligt i vand.
- Kuldioxid er en farveløs, lugtfri, ikke-giftig gas. Det er tungere end luft og opløseligt i vand.
5. Reaktioner og reaktivitet:
- Kulilte er en meget reaktiv gas, der let kan reagere med ilt og danne kuldioxid.
- Kuldioxid er en forholdsvis stabil gas, som ikke undergår mange reaktioner under normale forhold.
6. Biologisk betydning:
- Kulilte binder sig til hæmoglobin i blodet, hvilket reducerer de røde blodlegemers iltbærende kapacitet, hvilket kan føre til vævshypoksi og endda død.
- Kuldioxid er et produkt af cellulær respiration og transporteres fra væv til lungerne for at blive udåndet. Det er også involveret i at regulere blodets pH og opretholde syre-base balance.
7. Miljøpåvirkning:
- Kulilte er et forurenende stof, der udsendes fra biler, industrielle processer og ufuldstændig forbrænding af brændstoffer. Det bidrager til luftforurening og kan have negative virkninger på menneskers sundhed.
- Kuldioxid er en drivhusgas, der bidrager til global opvarmning og klimaændringer, når den frigives i store mængder.
Overordnet set er kulilte og kuldioxid forskellige kemiske forbindelser med forskellige molekylære strukturer, egenskaber og biologiske og miljømæssige implikationer.
 Varme artikler
Varme artikler
-
 Geometrisk forvirrende kvasikrystaller fundet i resterne af den første atomsprængning nogensindeVarmen og trykket fra en atomeksplosion kan frembringe usædvanlige kemiske kuriositeter. Kredit:United States Department of Energy/wikimedia Nukleare detonationer udløser en forbløffende mængde de
Geometrisk forvirrende kvasikrystaller fundet i resterne af den første atomsprængning nogensindeVarmen og trykket fra en atomeksplosion kan frembringe usædvanlige kemiske kuriositeter. Kredit:United States Department of Energy/wikimedia Nukleare detonationer udløser en forbløffende mængde de -
 En blidere, mere præcis laserskæringsteknikPac-Man udskæring ved laserskæring. Kredit:H. Borchers et al. Laserskæringsteknikker drives normalt af højenergistråler, så varme, at de smelter de fleste materialer. Nu har forskere fra McGill Uni
En blidere, mere præcis laserskæringsteknikPac-Man udskæring ved laserskæring. Kredit:H. Borchers et al. Laserskæringsteknikker drives normalt af højenergistråler, så varme, at de smelter de fleste materialer. Nu har forskere fra McGill Uni -
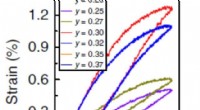 Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill
Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill -
 Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan
Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan
- Er der noget, der hedder en virkelig uselvisk handling?
- Sådan certificeres en kvantecomputer
- Digitaliserede ansigter reducerer risikoen for butikstyveri ved selvbetjening
- Ny syntese af komplekse organiske molekyler afsløret
- Babystjerners brændende raserianfald kunne skabe planeternes byggesten
- Sådan tegnes decimaler


