Hvordan holdes atomer sammen i molekyler?
Kovalente bindinger dannes, når to eller flere atomer deler elektroner. De delte elektroner holdes i et område af rummet mellem atomerne kaldet en molekylær orbital. Den molekylære orbital er et område, hvor sandsynligheden for at finde de delte elektroner er højest. Kovalente bindinger er den stærkeste type kemisk binding.
Ionbindinger dannes, når et atom overfører en eller flere elektroner til et andet atom. Atomet, der mister elektronerne, bliver positivt ladet, og det atom, der får elektronerne, bliver negativt ladet. De modsat ladede ioner tiltrækkes af hinanden af elektrostatiske kræfter. Ionbindinger er svagere end kovalente bindinger, men de er stadig meget stærke.
Metalbindinger dannes, når metalatomers valenselektroner delokaliseres, hvilket betyder, at de ikke er forbundet med noget bestemt atom. De delokaliserede elektroner danner et "hav" af elektroner, der flyder gennem metallet. Metalliske bindinger er den svageste type kemisk binding, men de er stadig stærke nok til at holde metaller sammen.
Den type kemiske binding, der dannes mellem to atomer, afhænger af atomernes elektronegativitet. Elektronegativitet er et mål for, hvor stærkt et atom tiltrækker elektroner. Jo større forskellen er i elektronegativitet mellem to atomer, jo stærkere er den kemiske binding mellem dem.
 Varme artikler
Varme artikler
-
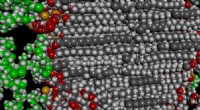 Hudcremer er ikke, hvad vi troede, de varModel af den molekylære struktur af en creme, med atomerne af et overfladeaktivt stof og co-overfladeaktivt stof i lamellen vist i lys og mørkegrå i midten af billedet, og atomer af et konserverings
Hudcremer er ikke, hvad vi troede, de varModel af den molekylære struktur af en creme, med atomerne af et overfladeaktivt stof og co-overfladeaktivt stof i lamellen vist i lys og mørkegrå i midten af billedet, og atomer af et konserverings -
 Programmerbare bløde aktuatorer viser det store potentiale i blød robotikForskere udvikler bløde aktuatorer, der vil give robotter en blød touch. Kredit:Delft University of Technology Forskere ved TU Delft har udviklet meget programmerbare aktuatorer, der bl. ligner de
Programmerbare bløde aktuatorer viser det store potentiale i blød robotikForskere udvikler bløde aktuatorer, der vil give robotter en blød touch. Kredit:Delft University of Technology Forskere ved TU Delft har udviklet meget programmerbare aktuatorer, der bl. ligner de -
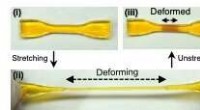 Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore
Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore -
 Eksperimentelle fysikere studerer stål om bord på ISSPeter Pichler (tv) med arbejdsgruppeleder Gernot Pottlacher (th.). Fra stålstangen i deres hænder, de skar de små bolde, som nu bliver undersøgt på ISS. Kredit:Baustädter - TU Graz I mange år, Ins
Eksperimentelle fysikere studerer stål om bord på ISSPeter Pichler (tv) med arbejdsgruppeleder Gernot Pottlacher (th.). Fra stålstangen i deres hænder, de skar de små bolde, som nu bliver undersøgt på ISS. Kredit:Baustädter - TU Graz I mange år, Ins
- Varmebeholdningsvidenskabelige projekter
- Oregon stemmer for at forbyde restauranter i at tilbyde plastiksugerør
- Sådan fungerer undersøgelser af flystyrt, ifølge en luftfartssikkerhedsekspert
- Nyt værktøj hjælper med at minimere effekten af solaktivitet
- Microsoft afslører nye Surface -enheder, inklusive hovedtelefoner
- Et nyt kort til et fødested for stjerner


