Hvordan hænger temperatur og hydrogenbindinger sammen?
Når temperaturen af vand stiger, stiger vandmolekylernes kinetiske energi også. Denne øgede energi får vandmolekylerne til at bevæge sig hurtigere og oftere kollidere med hinanden. Som et resultat bliver brintbindingerne mellem vandmolekyler svagere og kan lettere brydes. Denne svækkelse og brydning af hydrogenbindinger fører til et fald i den samlede styrke af de intermolekylære kræfter mellem vandmolekyler.
Ved stuetemperatur (25°C) er vandmolekyler i stand til at danne et betydeligt antal hydrogenbindinger, hvilket resulterer i en relativt stærk intermolekylær kraft og en flydende tilstand. Men efterhånden som temperaturen øges, bliver hydrogenbindingerne svagere, hvilket fører til et fald i den intermolekylære kraft og til sidst får det flydende vand til at gå over i en gas (vanddamp) ved dets kogepunkt (100°C).
Sammenfattende svækker og forstyrrer stigende temperatur hydrogenbindinger mellem molekyler, hvilket igen mindsker styrken af de intermolekylære kræfter og kan påvirke et stofs fysiske egenskaber.
Sidste artikelHvad dannes ved at CaO reagerer med Hcl?
Næste artikelBestår atomer af molekyler?
 Varme artikler
Varme artikler
-
 Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale.
Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale. -
 Udnyttelse af lys til en soldrevet kemisk industriLektor ved RMIT University Daniel Gomez, holder en skive dækket af det nano-forbedrede palladium. Kredit:RMIT University Ny teknologi, der udnytter sollys til at drive kemiske reaktioner, baner ve
Udnyttelse af lys til en soldrevet kemisk industriLektor ved RMIT University Daniel Gomez, holder en skive dækket af det nano-forbedrede palladium. Kredit:RMIT University Ny teknologi, der udnytter sollys til at drive kemiske reaktioner, baner ve -
 Grænseflade med hjernenNervesystemet er fyldt med kodet information:tanker, følelser, motorstyring. Dette system i vores kroppe er en gåde, og jo mere vi kan gøre for at forstå det, jo mere kan vi gøre for at forbedre menne
Grænseflade med hjernenNervesystemet er fyldt med kodet information:tanker, følelser, motorstyring. Dette system i vores kroppe er en gåde, og jo mere vi kan gøre for at forstå det, jo mere kan vi gøre for at forbedre menne -
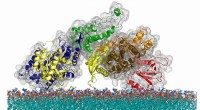 Banebrydende undersøgelse af cellesignalering lover for immunforskning og videreDen atomare struktur af SOS-proteinet, et cellemeddelelsesmolekyle, der bruger en unik timingmekanisme til at regulere aktiveringen af en kritisk immunsystemvej. Kredit:Steven Alvarez/Berkeley Lab
Banebrydende undersøgelse af cellesignalering lover for immunforskning og videreDen atomare struktur af SOS-proteinet, et cellemeddelelsesmolekyle, der bruger en unik timingmekanisme til at regulere aktiveringen af en kritisk immunsystemvej. Kredit:Steven Alvarez/Berkeley Lab
- Viser sig, at jordens puls 'slår' hvert 27.5 million år, men hvorfor?
- Iskerner viser, at selv sovende vulkaner lækker rigeligt svovl ud i atmosfæren
- I luften og på jorden, en Azorerne søger efter bedre data
- Hurtigst formørkende binær, et værdifuldt mål for gravitationsbølgestudier
- Genbrug af bordservice kan reducere spild fra online madleverancer
- Plan for stor tilgivelse af studielån annonceret af Biden


