Banebrydende undersøgelse af cellesignalering lover for immunforskning og videre
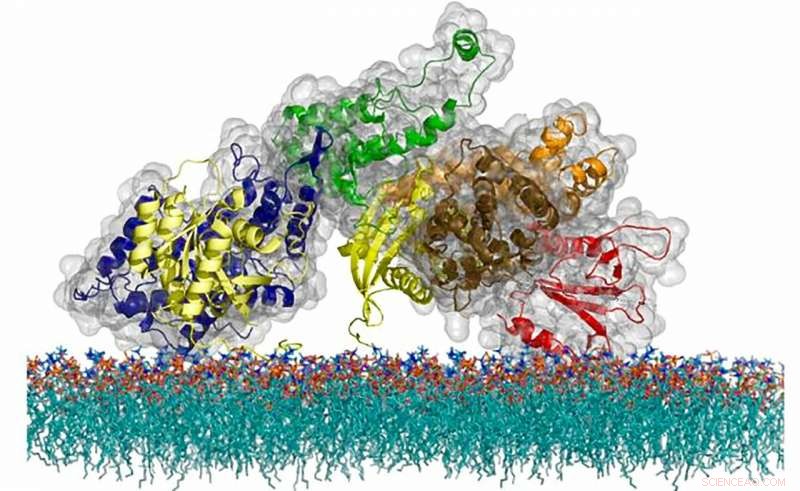
Den atomare struktur af SOS-proteinet, et cellemeddelelsesmolekyle, der bruger en unik timingmekanisme til at regulere aktiveringen af en kritisk immunsystemvej. Kredit:Steven Alvarez/Berkeley Lab
For første gang nogensinde, Forskere har afbilledet den proces, hvorved et individuelt immunsystemmolekyle tændes som reaktion på et signal fra omgivelserne, fører til den kritiske opdagelse, at aktiveringsprocessen involverer hundredvis af proteiner, der pludselig samles for at danne et forbundet netværk gennem en proces kendt som en faseovergang.
Det nye værk, beskrevet i et papir for nylig offentliggjort i Videnskab , giver et enormt spring fremad i vores forståelse af, hvordan immunsystemet er finjusteret til at detektere selv et enkelt virusmolekyle midt i et hav af millioner af andre molekyler, giver os mulighed for hurtigt at komme os over virusinfektioner såsom influenza. Ved at lære, hvordan disse særlige proteiner virker, videnskabsmænd vil også have en bedre forståelse af, hvorfor deres aktivitet nogle gange går skævt - hændelser, der kan føre til autoimmune sygdomme, såsom diabetes eller leddegigt – og kan give enestående indsigt i, hvordan man styrer en kræftpatients eget immunsystem til at helbrede kræft.
"Dette er noget, der sker inde i en levende celle under processen, hvor cellen træffer en beslutning - signaltransduktion er, hvad vi kalder det - og det er, hvordan celler 'tænker' med kemiske reaktioner, " sagde studieleder Jay Groves, en fakultetskemiker i biovidenskabsområdet i Department of Energy's Lawrence Berkeley National Laboratory (Berkeley Lab). "På området for biologi som helhed, ideen om en proteinkondensationsfaseovergang har fået stor opmærksomhed på det seneste. Mange grupper over hele verden studerer disse fænomener, men indtil nu, ingen vidste, hvordan eller hvorfor cellen bruger dem.
"Vores papir er, Jeg tror, den første til direkte at teste og bekræfte, hvordan en faseovergang kan regulere signalering, " sagde Groves. "Og den store opdagelse er, at det er en molekylær timingmekanisme. Cellen bruger tid på at skelne en ægte receptorstimulering fra kemisk baggrundsstøj."
Studerer en vigtig cellebudbringer
Holdets afsløring kom i stand som en del af den igangværende forskning fra Groves lab om de fysiske mekanismer af T-cellesignalering og Ras-proteinet. Findes i alle eukaryote celler i flere variationer, Ras har mange hatte på, herunder fungere som en regulator for cellevækst, division, og døden. T-celler, immunsystemets celler, der opdager fremmede og potentielt skadelige infektioner, brug Ras som en tænd-sluk-knap til indbrudsalarmstien, der starter en beskyttende reaktion. T-cellens evne til at skelne et rigtigt eksternt signal - når et fremmed molekyle binder til den passende navngivne T-cellereceptor (TCR) på celleoverfladen - fra utilsigtet kontakt med nærliggende proteiner er afgørende for et fungerende immunsystem. Hvis en T-celle ved et uheld reagerer på et af vores egne molekyler, så kan der udvikles en autoimmun sygdom. På samme tid, hvis en T-celle mister sin følsomhed, så vil vira kunne vokse ukontrolleret, og kræftceller vil ikke blive fjernet fra kroppen.
På grund af de brede konsekvenser for menneskers sundhed, forskere har længe undret sig over, hvordan cellerne regulerer deres signaler for at opnå denne balance. Tidligere forskning havde afsløret, at en T-celles Ras-proteiner ikke interagerer direkte med cellereceptorer. I stedet, receptorer sender "on"-signalet til interne mellemliggende proteiner, inklusive en nøglegruppe på tre proteiner, kendt som LAT, Grb2, og SOS, som i sidste ende sender signalet videre til Ras. Forud for denne undersøgelse, videnskabsmænd vidste, at denne molekylære trio kunne forbindes i en faseovergangsproces, men ingen vidste, hvad faseovergangen gjorde. Og indtil for nylig, det var umuligt at finde ud af, fordi der ikke var nogen teknologi, der gjorde det muligt for forskere direkte at overvåge aktiviteten fra individuelle molekyler i komplekse cellemembransystemer.
Forskerholdet fjernede denne forhindring ved at opfinde en tilgang baseret på understøttede membranmikroarrays, en teknologi, som teamet har udviklet i mange år, der bruger stilladser lavet af nanofabrikerede strukturer til at holde cellemembraner.
Faseovergange på arbejdet
I den aktuelle undersøgelse, forskerne brugte mikroskopi til at se det øjeblik, hvor en T-cellereceptor på en understøttet membranmikroarray bad et enkelt SOS-molekyle om at aktiveres. I stedet for at svare med det samme, SOS ventede i 10 til 30 sekunder, før den skiftede til sin aktive tilstand. Hvis de nærliggende LAT- og Grb2-molekyler gennemgik faseovergangen med SOS, og kondenseret til deres samlede tilstand, de kunne holde SOS på membranen længe nok til at SOS kunne aktiveres. Uden faseovergangen, den lange forsinkelse i SOS-molekylet ville forhindre det i at aktiveres, før det forlod receptoren.
"Det er som om proteinet har en forsinkelse indbygget, " forklarede Groves. "Den har brug for faseovergangen kombineret med vedvarende signalering, og først derefter vil den tænde."
Selvom denne forskning var specifik for T-celle signalering, Groves og hans kolleger mener, at lignende faseovergangstidsmekanismer sandsynligvis er involveret i en række andre celleresponser. Nu hvor de etablerede en gennemprøvet eksperimentel teknik til at observere den molekylære aktivering af sådanne processer, holdet håber at løse flere langvarige mysterier om, hvordan celler udfører så mange komplekse opgaver.
 Varme artikler
Varme artikler
-
 Materiale til at hjælpe med overgangen til rent brintbrændstofTitaniumoxid-katalysatoren Kredit:University of Wollongong Planters evne til at høste sollys og spalte vand til brint og ilt gennem fotosyntese har længe fascineret videnskabsmænd, som har forsøgt
Materiale til at hjælpe med overgangen til rent brintbrændstofTitaniumoxid-katalysatoren Kredit:University of Wollongong Planters evne til at høste sollys og spalte vand til brint og ilt gennem fotosyntese har længe fascineret videnskabsmænd, som har forsøgt -
 Hvordan keglen snegle dødelig gift kan hjælpe os med at bygge bedre medicinI det vilde, keglesnegle harpunerer deres bytte, mens det svømmer forbi. I laboratoriet, keglesneglen har lært at bytte gift ud med aftensmad. Her, en snegl forlænger sin snabel og udleder et skud gif
Hvordan keglen snegle dødelig gift kan hjælpe os med at bygge bedre medicinI det vilde, keglesnegle harpunerer deres bytte, mens det svømmer forbi. I laboratoriet, keglesneglen har lært at bytte gift ud med aftensmad. Her, en snegl forlænger sin snabel og udleder et skud gif -
 Nikkel i røntgenlysetForskere fra Argonne og University of California i Santa Barbara har identificeret en anden elementær aktør, der hjælper med at aktivere palladium og samtidig reducere mængden af det ædle metal, der
Nikkel i røntgenlysetForskere fra Argonne og University of California i Santa Barbara har identificeret en anden elementær aktør, der hjælper med at aktivere palladium og samtidig reducere mængden af det ædle metal, der -
 Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers
Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers
- For at bekæmpe fedtbjergene, vi er nødt til at gentænke, hvordan vi behandler spildevandsaffald
- Et trådløst plaster til overvågning af skadestuepatienter
- Find den rigtige dosis til solenergiingeniørarbejde
- Hvordan påvirker koncentrationen af en opløsning osmose?
- Forskere styrer flere bølgelængder af lys fra en enkelt kilde
- Universitetsuddannelse gør studerende mere behagelige, samvittighedsfuldhed


