Hvad bestemmer typen af binding, der dannes mellem atomer eller forbindelser?
1. Elektronegativitetsforskel:Elektronegativitet måler et atoms evne til at tiltrække elektroner mod sig selv. Når atomer med væsentligt forskellige elektronegativiteter binder sig, kan de danne forskellige typer bindinger:
- Ikke-polær kovalent binding:Hvis elektronegativitetsforskellen er minimal (mindre end 0,4), er den dannede binding upolær kovalent, hvor elektroner deles ligeligt mellem atomer.
- Polær kovalent binding:Når elektronegativitetsforskellen er mellem 0,4 og 1,7, dannes en polær kovalent binding, hvor det ene atom har en delvis negativ ladning og det andet en delvis positiv ladning.
- Ionbinding:Hvis elektronegativitetsforskellen er over 1,7, dannes en ionbinding, hvor det ene atom overfører elektroner til det andet, hvilket resulterer i dannelsen af positivt og negativt ladede ioner.
2. Valenselektroner:Antallet af valenselektroner, eller elektroner i det yderste energiniveau, spiller en afgørende rolle ved bestemmelse af bindingsdannelse:
- Kovalent binding:Atomer, der deler valenselektroner for at færdiggøre deres yderste skaller, danner kovalente bindinger.
- Metallisk binding:Metaller har løst bundne valenselektroner, der bevæger sig frit mellem positivt ladede metalioner, hvilket resulterer i metalliske bindinger.
3. Atomiske orbitaler:Formerne og symmetrierne af atomare orbitaler bestemmer, hvordan de overlapper hinanden for at danne bindinger. For eksempel:
- Overlapning af s orbitaler fører til sigma (σ) bindinger, som er cylindrisk symmetriske.
- Overlapning af p-orbitaler resulterer i pi (π)-bindinger, som har en side-by-side overlapning og skaber områder med elektrontæthed over og under den internukleære akse.
4. Bindingsrækkefølge:Antallet af elektronpar, der deles mellem atomer, bestemmer bindingsrækkefølgen:
- Enkeltbinding:Et enkelt elektronpar danner en enkeltbinding, typisk en σ-binding.
- Dobbeltbinding:To elektronpar danner en dobbeltbinding, bestående af en σ- og en π-binding.
- Tredobbelt binding:Tre elektronpar danner en tredobbelt binding, der består af en σ- og to π-bindinger.
5. Resonans og hybridisering:I nogle molekyler kan resonansstrukturer bidrage til den samlede binding. Hybridisering er blanding af atomare orbitaler for at skabe nye orbitaler med specifikke former, hvilket påvirker bindingsdannelse og egenskaber.
Adskillige andre faktorer, herunder molekylær geometri, tilstedeværelsen af ensomme par og påvirkningen af omgivende atomer, påvirker også typen af binding, der dannes mellem atomer eller forbindelser. At forstå disse faktorer er afgørende for at forudsige og forklare kemiske stoffers egenskaber og adfærd.
 Varme artikler
Varme artikler
-
 Ny kobberbelægning kunne blive den næste superbug fighterKredit:Pixabay/CC0 Public Domain En ny kobberbelægning, der dræber bakterier hurtigere og i større mængder end de nuværende formuleringer, kan snart være tilgængelig for hospitaler og andre højtraf
Ny kobberbelægning kunne blive den næste superbug fighterKredit:Pixabay/CC0 Public Domain En ny kobberbelægning, der dræber bakterier hurtigere og i større mængder end de nuværende formuleringer, kan snart være tilgængelig for hospitaler og andre højtraf -
 Måling af ethanol dødelig tvillingKvinder i Indien sælger hjemmebrygget alkohol, som kan indeholde giftige mængder methanol. Kredit:Shutterstock / Steve Estvanik ETH-forskere har udviklet en billig, håndholdt måleapparat, der kan
Måling af ethanol dødelig tvillingKvinder i Indien sælger hjemmebrygget alkohol, som kan indeholde giftige mængder methanol. Kredit:Shutterstock / Steve Estvanik ETH-forskere har udviklet en billig, håndholdt måleapparat, der kan -
 Forskere lægger ud med, hvordan man kan kontrollere biologi med lys - uden genetikEt fleksibelt siliciumnet kan tilpasse sig den bløde overflade af hjernen for at stimulere neural aktivitet. Kredit:Jiang et al/University of Chicago I løbet af de seneste fem år, Kemiker Bozhi Ti
Forskere lægger ud med, hvordan man kan kontrollere biologi med lys - uden genetikEt fleksibelt siliciumnet kan tilpasse sig den bløde overflade af hjernen for at stimulere neural aktivitet. Kredit:Jiang et al/University of Chicago I løbet af de seneste fem år, Kemiker Bozhi Ti -
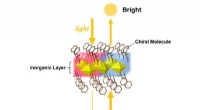 Nyt magnetdesign med spejllignende egenskaberDen magiske spejllignende magnet. Lysstyrken af det transmitterede lys fra magneten ændrer sig alt efter om materialet ses forfra eller bagfra. Kredit:Kouji Taniguchi Forskere ved Tohoku Univers
Nyt magnetdesign med spejllignende egenskaberDen magiske spejllignende magnet. Lysstyrken af det transmitterede lys fra magneten ændrer sig alt efter om materialet ses forfra eller bagfra. Kredit:Kouji Taniguchi Forskere ved Tohoku Univers
- Team udfører præcise målinger af de tungeste atomer
- Hvad driver hacktivisme? Afvejning af udbyttet mod risici
- En satellit med en harpun, net og træk sejl for at fange rumskrot er i kredsløb og vil snart blive…
- Sådan beregnes lift til rotorbladene
- Hvilken vej 'ud af Afrika'? Nye beviser giver en alternativ vej Afrika' for tidlige mennesker
- Forskere bruger NASA-data til at forudsige udseendet af den 14. 2020 formørkelse


