Hvorfor virker vand som opløsningsmiddel af ioniske forbindelser?
1. Polaritet:Vand er et polært molekyle, hvilket betyder, at det har en delvis positiv ladning i den ene ende (brintatomer) og en delvis negativ ladning i den anden ende (iltatom). Denne polaritet gør det muligt for vandmolekyler at interagere med ionerne i en ionisk forbindelse.
2. Hydrogenbinding:Vandmolekyler kan danne brintbindinger med ionerne i en ionforbindelse. Hydrogenbindinger er stærke dipol-dipol-interaktioner, der forekommer mellem elektronegative atomer (såsom oxygen) og hydrogenatomer bundet til andre elektronegative atomer (såsom oxygen, nitrogen eller fluor). Disse hydrogenbindinger hjælper med at opløse ionerne og holde dem adskilt i opløsningen.
3. Høj dielektrisk konstant:Vand har en høj dielektrisk konstant (ε =78,5 ved 25°C), hvilket betyder, at det har en høj kapacitet til at lagre elektrisk energi. Vandets høje dielektriske konstant svækker de elektrostatiske kræfter mellem de positive og negative ioner i en ionisk forbindelse, hvilket tillader forbindelsen at dissociere i dens bestanddele.
4. Ion-dipol-interaktioner:De polære vandmolekyler kan interagere med ionerne gennem ion-dipol-interaktioner. Den positive ende af vandmolekylet tiltrækkes af de negative ioner, mens den negative ende af vandmolekylet tiltrækkes af de positive ioner. Disse interaktioner hjælper med at omgive ionerne og holde dem adskilt i opløsningen.
5. Hydrationsenergi:Når en ionisk forbindelse opløses i vand, omgiver og opløser vandmolekylerne ionerne og frigiver hydreringsenergi. Denne energi frigives på grund af dannelsen af hydrogenbindinger og ion-dipol-interaktioner mellem vandmolekylerne og ionerne. Jo mere signifikant hydreringsenergien er, jo mere opløselig er den ioniske forbindelse i vand.
Samlet set gør kombinationen af vands polaritet, hydrogenbinding, høj dielektricitetskonstant, ion-dipol-interaktioner og hydreringsenergi det muligt at fungere som et effektivt opløsningsmiddel for ioniske forbindelser. Disse egenskaber gør det muligt for vand at opløse og dissociere ioniske forbindelser i deres respektive ioner, hvilket danner homogene opløsninger.
Sidste artikelHvad dannes når 2 glukosemolekyler kombineres?
Næste artikelHvad er pH-værdien af fortyndet carboxylsyre?
 Varme artikler
Varme artikler
-
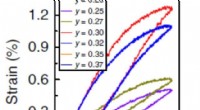 Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill
Nyt keramisk materiale kan reducere omkostningerne til piezoelektriske enhederKredit:Indian Institute of Science 1 procent), som er en markering af, hvor meget materialet kan ændre sin form, når det elektriske felt påføres. Imidlertid, de er meget dyre og svære at fremstill -
 Fundet:Katalysens hellige gral – at omdanne metan til methanol under omgivende forhold ved hjælp af…Kredit:ORNL/Jill Hemman Et internationalt team af forskere, ledet af forskere ved University of Manchester, har udviklet en hurtig og økonomisk metode til at omdanne metan, eller naturgas, til flyd
Fundet:Katalysens hellige gral – at omdanne metan til methanol under omgivende forhold ved hjælp af…Kredit:ORNL/Jill Hemman Et internationalt team af forskere, ledet af forskere ved University of Manchester, har udviklet en hurtig og økonomisk metode til at omdanne metan, eller naturgas, til flyd -
 Biobaserede produkter kan producere selvlysende tekstilerSelvlysende tekstiler kan fremstilles ved at bruge et bioluminescerende reaktionssystem. Dette er noget, Sweta Iyer, med sin nyslåede doktorgrad, har etableret. Hendes doktorafhandling inden for tekst
Biobaserede produkter kan producere selvlysende tekstilerSelvlysende tekstiler kan fremstilles ved at bruge et bioluminescerende reaktionssystem. Dette er noget, Sweta Iyer, med sin nyslåede doktorgrad, har etableret. Hendes doktorafhandling inden for tekst -
 Nye salte hæver barren for lithium-ion-batteriteknologiForskere håber at gøre disse nye anioner til termisk stabile, ikke-brændbare flydende salte, hvilket gør dem gavnlige for batterier, der arbejder ved høje temperaturer. Kredit:Monash University Li
Nye salte hæver barren for lithium-ion-batteriteknologiForskere håber at gøre disse nye anioner til termisk stabile, ikke-brændbare flydende salte, hvilket gør dem gavnlige for batterier, der arbejder ved høje temperaturer. Kredit:Monash University Li
- Slothbot tager en afslappet tilgang til miljøovervågning
- De fleste dårligt stillede børn står over for den største risiko for arbejdsløshed
- Når vand ved nul grader celsius opvarmes dets volumen?
- Ny rapport undersøger sikkerheden ved at bruge dispergeringsmidler til oprydning af oliespild
- Karakteristika og fysiske egenskaber af en Tiger
- Makrofager nanosvampe kunne holde sepsis i skak


