Hvorfor er det svært at bruge sæbe i en syreopløsning?
I en sur opløsning er opløsningens pH under 7, hvilket betyder, at der er flere hydrogenioner (H+) i opløsningen end hydroxidioner (OH-). H+ ionerne kan reagere med sæbemolekylerne og neutralisere ladningen på hovedgrupperne. Dette får micellerne til at gå i opløsning og frigive snavs og oliemolekyler tilbage i opløsningen. Som et resultat er sæbe ikke så effektiv til at rense i en sur opløsning, som den er i en neutral eller basisk opløsning.
 Varme artikler
Varme artikler
-
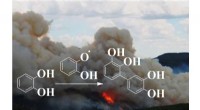 Brunt kulstof fra aromatiske forurenende stoffer udsendes under forbrænding og naturbrandeEn dimeriseringsreaktion af en polyphenol er afbildet til at forløbe ved grænseflader for at bidrage til dannelsen af brunt organisk kulstof under transporten af en røgfane. Kredit:Marcelo Guzman
Brunt kulstof fra aromatiske forurenende stoffer udsendes under forbrænding og naturbrandeEn dimeriseringsreaktion af en polyphenol er afbildet til at forløbe ved grænseflader for at bidrage til dannelsen af brunt organisk kulstof under transporten af en røgfane. Kredit:Marcelo Guzman -
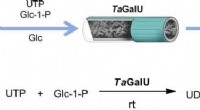 Trin for trin til slutproduktet gennem enzymkatalyseGrafisk abstrakt. Kredit:DOI:10.1016/j.cej.2021.131439 Enzymer (f.eks. dem, der stammer fra bakterier) kan omdanne en lang række forskellige udgangsmaterialer til et væld af målprodukter. Den såka
Trin for trin til slutproduktet gennem enzymkatalyseGrafisk abstrakt. Kredit:DOI:10.1016/j.cej.2021.131439 Enzymer (f.eks. dem, der stammer fra bakterier) kan omdanne en lang række forskellige udgangsmaterialer til et væld af målprodukter. Den såka -
 Identifikation af en ny, renere kilde til hvidt lysVed bestråling med infrarødt lys dannes adamantan-baserede molekylære klynger med den generelle sammensætning [(RT)4E5] (med R =organisk gruppe; T =C, Si, Ge, Sn; E =O, S, Se, Te, NH, CH2 , ON•) udsen
Identifikation af en ny, renere kilde til hvidt lysVed bestråling med infrarødt lys dannes adamantan-baserede molekylære klynger med den generelle sammensætning [(RT)4E5] (med R =organisk gruppe; T =C, Si, Ge, Sn; E =O, S, Se, Te, NH, CH2 , ON•) udsen -
 Forskere udvikler grønne alternativer til fossile råvarerStefan Spirk vil erstatte miljøskadelige komponenter med biobaserede materialer, primært stoffer fra papir- og papirmasseindustrien. © Lunghammer – TU Graz Som en vedvarende ressource, træ rummer
Forskere udvikler grønne alternativer til fossile råvarerStefan Spirk vil erstatte miljøskadelige komponenter med biobaserede materialer, primært stoffer fra papir- og papirmasseindustrien. © Lunghammer – TU Graz Som en vedvarende ressource, træ rummer
- Ny indsigt i, hvordan gener styrer frieri og aggression
- Forbedring af nøjagtigheden af internationale standarder for grafen
- Nanostrukturer bliver bedre til at høste sollys til generering af soldamp
- Der er behov for større fokus på, hvordan eksisterende international lov kan forhindre stigende mi…
- Hvordan en slank, slangelignende robot kunne give læger nye måder at redde liv på
- Eclipse-jagere tager til det sydlige Illinois for anden total solformørkelse på 7 år


