Hvordan opløses molekyler i vand?
Styrken af hydrogenbindingen mellem vandmolekyler og opløste molekyler bestemmer opløseligheden af det opløste stof i vand. Jo mere polært det opløste molekyle er, jo stærkere vil hydrogenbindingen være, og jo mere opløseligt vil det opløste stof være i vand.
For eksempel er sukker et polært molekyle, fordi det har hydroxyl (-OH) grupper, der kan danne hydrogenbindinger med vandmolekyler. Derfor er sukker meget opløseligt i vand.
I modsætning hertil er olie et upolært molekyle, fordi det ikke har nogen funktionelle grupper, der kan danne brintbindinger med vandmolekyler. Derfor er olie ikke blandbar med vand.
Polariteten af et molekyle kan også påvirkes af dets størrelse og form. Større molekyler har en tendens til at være mere polære end mindre molekyler. Dette skyldes, at større molekyler har mere overfladeareal for vandmolekyler at interagere med. Derudover har molekyler med en mere kompleks form en tendens til at være mere polære end molekyler med en simpel form. Dette skyldes, at molekyler med en mere kompleks form har flere funktionelle grupper, der kan interagere med vandmolekyler.
 Varme artikler
Varme artikler
-
 Gennembrud inden for forskning i ren dieselKredit:University of St. Andrews Et gennembrud i katalyseforskning udført af akademikere ved universiteterne i St. Andrews og Newcastle kan føre til udviklingen af ren dieselmotorteknologi og hj
Gennembrud inden for forskning i ren dieselKredit:University of St. Andrews Et gennembrud i katalyseforskning udført af akademikere ved universiteterne i St. Andrews og Newcastle kan føre til udviklingen af ren dieselmotorteknologi og hj -
 Tørrede skinkeknogler-en kilde til hjerte-sunde peptider?Kredit:ACS Drikkebenbouillon er en nylig diætfad, som fortalerne hævder bekæmper betændelse, letter ledsmerter og fremmer tarmsundhed. Simring af dyreknogler i vand frigiver kollagen og andre prot
Tørrede skinkeknogler-en kilde til hjerte-sunde peptider?Kredit:ACS Drikkebenbouillon er en nylig diætfad, som fortalerne hævder bekæmper betændelse, letter ledsmerter og fremmer tarmsundhed. Simring af dyreknogler i vand frigiver kollagen og andre prot -
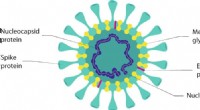 Antivirale overflader, overfladebelægninger og deres virkningsmekanismerFig. 1:Skematisk over en virusstruktur baseret på coronavirus. Kredit: Kommunikationsmaterialer (2021). DOI:10.1038/s43246-021-00153-y Forskere fra The National Physical Laboratory (NPL) og Natio
Antivirale overflader, overfladebelægninger og deres virkningsmekanismerFig. 1:Skematisk over en virusstruktur baseret på coronavirus. Kredit: Kommunikationsmaterialer (2021). DOI:10.1038/s43246-021-00153-y Forskere fra The National Physical Laboratory (NPL) og Natio -
 Ny teknologi forbedrer brintproduktionenINL-forskere demonstrerede højtydende elektrokemisk brintproduktion ved en lavere temperatur, end det havde været muligt før. Kredit:Idaho National Laboratory Industrielt brint er tættere på at bl
Ny teknologi forbedrer brintproduktionenINL-forskere demonstrerede højtydende elektrokemisk brintproduktion ved en lavere temperatur, end det havde været muligt før. Kredit:Idaho National Laboratory Industrielt brint er tættere på at bl
- Hvad sker der, hvis vand og borax blandes sammen?
- Ved at stykke Alaskas kystlinjer sammen brød vulkansk aktivitet
- Ny hastighedsrekord for fangede-ion byggeklodser i kvantecomputere
- Hvordan klimaændringer og invasive arter truer løvfrøer
- Observationen af en Spin Berry krumning-forstærket orbital Zeeman-effekt i et kagome-metal
- Computerforsker har til formål at beskytte mennesker i en alder af kunstig intelligens


