Hvorfor er ammoniak let at gøre flydende end andre gasser med samme molekylvægt?
1. Hydrogenbinding:Ammoniakmolekyler udviser stærk hydrogenbinding på grund af nitrogens elektronegative natur og tilstedeværelsen af brintatomer. Hydrogenbinding involverer tiltrækningen mellem et brintatom, der er kovalent bundet til et stærkt elektronegativt atom (såsom nitrogen) og et andet stærkt elektronegativt atom. Disse intermolekylære kræfter skaber et stærkt netværk af attraktioner mellem ammoniakmolekyler, der holder dem tættere sammen og fremmer væskedannelse.
2. Højt dipolmoment:Ammoniakmolekylet har et signifikant dipolmoment på grund af forskellen i elektronegativitet mellem nitrogen og brint. Det elektronegative nitrogenatom tiltrækker elektroner mod sig selv, hvilket skaber en delvis positiv ladning på brintatomerne og en delvis negativ ladning på nitrogenatomet. Denne polaritet gør det muligt for ammoniakmolekyler at justere og tiltrække hinanden gennem dipol-dipol-interaktioner, hvilket bidrager til, at de er nemme at flydende.
3. Van der Waals-kræfter:Udover hydrogenbinding oplever ammoniak også van der Waals-kræfter, som er svage tiltrækningskræfter, der er til stede mellem alle molekyler. Mens van der Waals kræfter er svagere end hydrogenbindinger, bidrager de stadig til ammoniakmolekylernes sammenhængende natur og øger deres fortætningstendens.
Som et resultat af disse stærke intermolekylære kræfter holdes ammoniakmolekyler tættere sammen sammenlignet med andre gasser med lignende molekylvægte. Dette resulterer i et højere kogepunkt (-33,34 °C) og en lavere kritisk temperatur (132,4 °C) for ammoniak, hvilket gør det lettere at gøre det flydende end andre gasser med lignende molekylvægt under omgivende forhold.
I modsætning hertil har gasser med lignende molekylvægte, men svagere intermolekylære kræfter, såsom metan (CH4) og oxygen (O2), lavere kogepunkter og højere kritiske temperaturer. Denne forskel i flydende adfærd fremhæver den betydelige indflydelse af intermolekylære kræfter på de fysiske egenskaber af gasser.
Sidste artikelHvordan opløses molekyler i vand?
Næste artikelLugter jern(II)nitrat?
 Varme artikler
Varme artikler
-
 Konstrueret E. coli kunne lave kulhydrater, vedvarende brændstof, fra CO2Kredit:Pixabay/CC0 Public Domain Forskere fra Newcastle University, UK har konstrueret Escherichia coli bakterier til at opfange kuldioxid (CO 2 ) ved hjælp af brintgas (H 2 ) for at omdanne
Konstrueret E. coli kunne lave kulhydrater, vedvarende brændstof, fra CO2Kredit:Pixabay/CC0 Public Domain Forskere fra Newcastle University, UK har konstrueret Escherichia coli bakterier til at opfange kuldioxid (CO 2 ) ved hjælp af brintgas (H 2 ) for at omdanne -
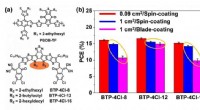 Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot -
 Overvejer duften af vinKredit:CC0 Public Domain En god vin har en ideel balance af ingredienser. For meget eller for lidt af en komponent kan betyde forskellen mellem en vin med en sød og frugtagtig aroma og en, der duf
Overvejer duften af vinKredit:CC0 Public Domain En god vin har en ideel balance af ingredienser. For meget eller for lidt af en komponent kan betyde forskellen mellem en vin med en sød og frugtagtig aroma og en, der duf -
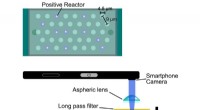 Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma
Smartphone virusscanner:Ny bærbar enhed lader smartphones tælle biologiske viraDe virusholdige hulrum er 4,5 mikrometer på tværs og 9 mikrometer fra hinanden. Kredit:Minagawa et al. Den nuværende førende metode til at vurdere tilstedeværelsen af vira og andre biologiske ma
- SureFly holder fokus på en ny dag i sikker, to-sæders fly
- Karakteristika for økosystemet
- Hvad er den hurtigste hastighed opnået ved menneskeskabt fremdrift?
- Hvilke andre grundstoffer kombineres polonium med?
- Chip-baseret enhed åbner nye døre for augmented reality og quantum computing
- Hvad sker der med din krypto, hvis du dør?


