Hvordan vil du bevise, at volumen af et atom hovedsageligt er det tomme rum?
1. Rutherford-spredningseksperiment:
- I 1911 udførte Ernest Rutherford et guldfolieeksperiment, hvor han bombarderede et tyndt ark guldfolie med alfapartikler (heliumkerner).
- De fleste af alfapartiklerne passerede gennem folien uden væsentlige afbøjninger, hvilket indikerer, at det meste af atomets volumen er tomt rum.
- Et lille antal alfapartikler blev afbøjet i store vinkler, hvilket indikerer, at atomets positive ladning og masse er koncentreret i en meget lille, tæt kerne.
2. Beregninger baseret på atomstruktur:
- Atomkernen, som indeholder protoner og neutroner, er utrolig lille i forhold til atomets samlede størrelse.
- Kernens radius er i størrelsesordenen femtometre (10^-15 meter), hvorimod atomets radius er i størrelsesordenen ångstrøm (10^-10 meter).
- Langt størstedelen af atomets volumen er derfor optaget af elektronskyen, som er et område, hvor elektroner bevæger sig rundt i kernen.
3. Sammenligning af massefylde af faste stoffer og atomer:
- Et objekts massefylde er defineret som masse pr. volumenenhed.
- Densiteten af de fleste faste stoffer er i størrelsesordenen gram pr. kubikcentimeter (g/cm^3).
- Imidlertid er tætheden af atomer utrolig lav, typisk i størrelsesordenen 10^-24 g/cm^3. Denne enorme forskel i tæthed indikerer, at atomer for det meste er tomme rum.
4. Gassers egenskaber:
- Gasser udviser egenskaber som lav densitet, høj komprimerbarhed og evnen til at flyde let.
- Disse egenskaber kan forklares ved at overveje, at gasatomer er relativt langt fra hinanden.
- Det store tomme rum mellem gasatomer giver dem mulighed for at bevæge sig frit og optage et større volumen.
Samlet set indikerer de forskellige eksperimentelle beviser og teoretiske beregninger, at volumenet af et atom overvejende er tomt rum, hvor størstedelen af atomets masse er koncentreret i den lille atomkerne.
 Varme artikler
Varme artikler
-
 Kviksølvfjernelse gjort let i giftige miljøerKredit:Pixabay/CC0 Public Domain Kviksølvforurening er et globalt problem i vand, luft og jord i nærheden af guldminer, cement og noget metalproduktion og andre tunge industrier, der brænder foss
Kviksølvfjernelse gjort let i giftige miljøerKredit:Pixabay/CC0 Public Domain Kviksølvforurening er et globalt problem i vand, luft og jord i nærheden af guldminer, cement og noget metalproduktion og andre tunge industrier, der brænder foss -
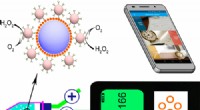 Nye sensorer kan muliggøre en mere overkommelig påvisning af forurening og sygdommeKredit:American Chemical Society Når det kommer til at teste for kræft, miljøforurening og fødevareforurenende stoffer, traditionelle sensorer kan hjælpe. Udfordringerne er, at de ofte er omfangsr
Nye sensorer kan muliggøre en mere overkommelig påvisning af forurening og sygdommeKredit:American Chemical Society Når det kommer til at teste for kræft, miljøforurening og fødevareforurenende stoffer, traditionelle sensorer kan hjælpe. Udfordringerne er, at de ofte er omfangsr -
 Prøveopbevaringsmetode kunne forbedre sundhedsplejen i ressourcebegrænsede regionerKredit:offentlig ejendom Blod- og urinprøver spiller vitale roller i moderne medicin. Men i store områder af verden, hvor køling ikke er tilgængelig, at bevare prøver til test er praktisk talt umu
Prøveopbevaringsmetode kunne forbedre sundhedsplejen i ressourcebegrænsede regionerKredit:offentlig ejendom Blod- og urinprøver spiller vitale roller i moderne medicin. Men i store områder af verden, hvor køling ikke er tilgængelig, at bevare prøver til test er praktisk talt umu -
 At skinne lys på en væske ændrer fuldstændig dens dielektriske permittivitetBlinkende blåt lys (venstre) på væsken fik den til at skifte til en høj dielektrisk permittivitetsfase, mens skinnende grønt lys på den (højre) vendte ændringen. Kredit:H. Nishikawa et al , CC BY 4.0
At skinne lys på en væske ændrer fuldstændig dens dielektriske permittivitetBlinkende blåt lys (venstre) på væsken fik den til at skifte til en høj dielektrisk permittivitetsfase, mens skinnende grønt lys på den (højre) vendte ændringen. Kredit:H. Nishikawa et al , CC BY 4.0
- Har du virkelig brug for mere benzin, eller toiletpapir? Der er bedre måder at tage kontrol i en kr…
- Lyser på international energiulighed
- IonQ annoncerer udvikling af næste generations kvantecomputer
- Ny termodynamisk ramme til celler
- Massivt klippekunststed i Outback afslører en gammel fortælling
- Tørvebaserede klimarekonstruktioner løber ud i grumsete vande?


