Hvorfor har sukker en stærkere intermolekylær kraft end ammoniak?
Sukker (saccharose) er en kovalent forbindelse, hvilket betyder, at den består af atomer, der holdes sammen af fælles elektroner. De intermolekylære kræfter i sukker er van der Waals-kræfter. Van der Waals-kræfter er svage tiltrækningskræfter, der opstår mellem alle molekyler. De er forårsaget af udsving i elektronskyen af et molekyle, som skaber midlertidige positive og negative ladninger.
Ammoniak (NH3) er en polær kovalent forbindelse, hvilket betyder, at den har en permanent positiv ende og en permanent negativ ende. De intermolekylære kræfter i ammoniak er hydrogenbindinger. Hydrogenbindinger er meget stærkere end van der Waals-kræfter. Denne stærkere tiltrækning mellem molekyler er grunden til, at ammoniak har et lavere smeltepunkt og kogepunkt end sukker. Hydrogenbindinger får molekylerne i ammoniak til at blive stærkere tiltrukket af hinanden, hvilket gør det sværere at skille dem ad.
Sammenfattende har sukker svagere van der Waals-kræfter mellem sine molekyler, mens ammoniak har stærkere hydrogenbindinger mellem sine molekyler. Denne forskel i intermolekylære kræfter fører til forskellige fysiske egenskaber, såsom smeltepunkter og kogepunkter.
Sidste artikelNår vandet opvarmes, vil partiklerne?
Næste artikelHvorfor danner d-blokelementerne komplekser?
 Varme artikler
Varme artikler
-
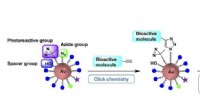 Let monterede guld nanopartikel stilladser tjener som molekylær sondeEt-trins forberedelse af fotoaffinitetsprober ved hjælp af klikbare guld-nanopartikel-prækursorer muliggør hensigtsmæssige målidentifikationsundersøgelser Kredit:Figur modificeret fra organisk og biom
Let monterede guld nanopartikel stilladser tjener som molekylær sondeEt-trins forberedelse af fotoaffinitetsprober ved hjælp af klikbare guld-nanopartikel-prækursorer muliggør hensigtsmæssige målidentifikationsundersøgelser Kredit:Figur modificeret fra organisk og biom -
 Forskere udvikler klæbemiddel med industriel styrke, som kan løsnes i magnetfeltetKredit:CC0 Public Domain Forskere ved University of Sussex har udviklet en lim, som kan løsne sig, når den placeres i et magnetfelt, dvs. produkter, der ellers er bestemt til deponering, kunne nu
Forskere udvikler klæbemiddel med industriel styrke, som kan løsnes i magnetfeltetKredit:CC0 Public Domain Forskere ved University of Sussex har udviklet en lim, som kan løsne sig, når den placeres i et magnetfelt, dvs. produkter, der ellers er bestemt til deponering, kunne nu -
 Lab-on-a-chip test har potentiale til at opdage COVID-19 immunrespons hurtigere end nuværende antis…Kredit:SMU En ny antistoftest, der udvikles af et hold, der omfatter to SMU-forskere, har potentialet til at opdage tilstedeværelsen af antistoffer genereret som reaktion på COVID-19 hurtigere o
Lab-on-a-chip test har potentiale til at opdage COVID-19 immunrespons hurtigere end nuværende antis…Kredit:SMU En ny antistoftest, der udvikles af et hold, der omfatter to SMU-forskere, har potentialet til at opdage tilstedeværelsen af antistoffer genereret som reaktion på COVID-19 hurtigere o -
 Forskere udvikler unikt glødende proteinKredit:MIPT Biofysikere fra Moskva Institut for Fysik og Teknologi er gået sammen med kolleger fra Frankrig og Tyskland for at skabe et nyt fluorescerende protein. Udover at gløde, når det bestrål
Forskere udvikler unikt glødende proteinKredit:MIPT Biofysikere fra Moskva Institut for Fysik og Teknologi er gået sammen med kolleger fra Frankrig og Tyskland for at skabe et nyt fluorescerende protein. Udover at gløde, når det bestrål
- Forskere opdager det grundlæggende i, hvordan trykfølende Piezo-proteiner virker
- Team udvikler teknologi til ansigtsgenkendelse, der fungerer i mørket
- Nye NASA -billeder afslører snedækkede Mars -klitter
- Løs mysteriet om, hvorfor atmosfærisk kuldioxid var lavere i istiden
- Historiske tegn i landskabet:Undersøgelse af pollarderingspraksis i Vestnorge
- Typer af hygrometre


