Let monterede guld nanopartikel stilladser tjener som molekylær sonde
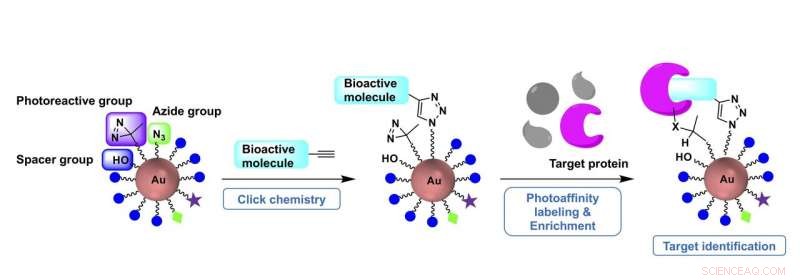
Et-trins forberedelse af fotoaffinitetsprober ved hjælp af klikbare guld-nanopartikel-prækursorer muliggør hensigtsmæssige målidentifikationsundersøgelser Kredit:Figur modificeret fra organisk og biomolekylær kemi, januar 2021, DOI:10.1039/D0OB01688H
Udviklingen af farmaceutiske behandlinger er vanskelig - klinikere og forskere ved, at et bestemt lægemiddel kan regulere bestemte funktioner, men de ved måske ikke, hvordan det rent faktisk fungerer. Forskere ved Tokyo University of Agriculture and Technology (TUAT) har udviklet en ny, strømlinet metode til bedre at forstå de molekylære mekanismer, der understøtter disse interaktioner.
De offentliggjorde deres tilgang den 17. december, 2020 i Organisk og biomolekylær kemi, et tidsskrift fra U.K. Royal Society of Chemistry.
"Vi satte os for at udvikle en ny guld-nanopartikel-baseret metode til målidentifikation af bioaktive små molekyler, der strømliner de nuværende besværlige trin, så vi hurtigt kan finde ud af, hvordan disse molekyler fungerer, " sagde Kaori Sakurai, lektor ved Institut for Bioteknologi og Biovidenskab på TUAT.
Bioaktive små molekyler er kemiske forbindelser, såsom lægemidler, som let kan leveres til og interagere med en krops celler. Ved at binde sig til specifikke proteiner, disse molekyler kan omkoble en biologisk proces for at stoppe eller forbedre, hvad end den oprindelige funktion var. For eksempel, de bioaktive små molekyler i et anticancermiddel vil binde med et protein i kræftceller for at hæmme deres ukontrollerede vækst. De kan endda narre kræftcellerne til programmeret celledød.
Udfordringen er, at det ikke altid er klart, hvilke proteiner der er målrettet mod, eller om der er andre målrettede proteiner, som potentielt kan forårsage uønskede bivirkninger. Ved at bruge en teknologi kaldet fotoaffinitetsmærkning, forskere kan kaste lys over målproteiner og øjeblikkeligt mærke dem, at fange og identificere dem. Imidlertid, fotoaffinitetsmærkning kræver omfattende tid og ressourcer til at udvikle det specifikke tag, sikre, at det er knyttet til det rigtige mål i cellen, og oprens derefter det mærkede målprotein.
"Fotoaffinitetsmærkning er en kraftfuld tilgang til opdagelsen af små molekyle-målproteiner, " sagde Sakurai. "Men, dets rutinemæssige brug er blevet hæmmet af flere problemer, inklusive ineffektiv proteinmærkning og efterfølgende oprensning og tekniske vanskeligheder med at lave bioaktive små molekyler til egnede prober."
Sakurais team har tidligere givet en løsning på det første problem ved at bruge en guld nanopartikel som modulært stillads, hvorpå en specifik sonde kan designes. I den seneste avis, de fokuserede på at udvikle en et-trins forberedelsesproces.
Da guld nanopartikler har overflader, der kan holde modulære stykker, forskerne kan effektivt bygge skræddersyede samlinger ved blot at blande byggeklodser, ifølge papirets medforfatter Kanna Mori, en kandidatstuderende på Institut for Bioteknologi og Biovidenskab på TUAT.
"Fotoaffinitetsprober kan let opnås fra probe-forstadier, formonteret med tre typer byggeklodser - hver med en klikbar gruppe, en fotoreaktiv gruppe og en vandopløselig spacer-gruppe - og inkorporer derefter hurtigt et lille molekyle af interesse gennem klikkemi, " sagde Mori.
Det fremstillede lille molekyle, selv efter at være blevet konjugeret til nanopartikler, opfører sig som et modermolekyle, der naturligt vil binde til et protein, og den fotoreaktive gruppe reagerer på ultraviolet lysbestråling, der aktiverer sonden. Når først aktiveret, proben kan fange og isolere et målprotein.
"Vi demonstrerede, at klikbare fotoaffinitetsprobeforstadier vil give hurtig adgang til fotoaffinitetsprober af forskellige typer bioaktive små molekyler for at identificere deres målproteiner, " sagde Sakurai.
Næste, forskerne planlægger at udforske nytten af guld-nanopartikelprober i målidentifikationsundersøgelser i levende celler, udvide deres arbejde til at tage højde for fysiologiske forhold. De planlægger også at introducere komplekse naturlige produkter og nogle lægemidler i guld-nanopartiklerne for at begynde at identificere deres ukendte målproteiner.
 Varme artikler
Varme artikler
-
 Øget anvendelighed og præcision i vaskulær billeddannelse3-D billeddannelse af blodkarrene i et musehoved ved hjælp af røntgencomputertomografi og det nyudviklede kontrastmiddel XlinCA. Kredit:Willy Kuo, Universitetet i Zürich Forskere ved universitetet
Øget anvendelighed og præcision i vaskulær billeddannelse3-D billeddannelse af blodkarrene i et musehoved ved hjælp af røntgencomputertomografi og det nyudviklede kontrastmiddel XlinCA. Kredit:Willy Kuo, Universitetet i Zürich Forskere ved universitetet -
 Molekylær kortlægning gjort let3D-kort over molekylerne på en pengeautomat. Dette kort viser, hvordan vi overfører molekyler fra vores hud til de objekter, vi interagerer med, give oplysninger, der kan have mange retsmedicinske anv
Molekylær kortlægning gjort let3D-kort over molekylerne på en pengeautomat. Dette kort viser, hvordan vi overfører molekyler fra vores hud til de objekter, vi interagerer med, give oplysninger, der kan have mange retsmedicinske anv -
 Team udvikler hurtig autentificeringsmetode for kinesisk medicinPolyUs forskerhold ledet af Dr Yao Zhongping, lektor ved Institut for Anvendt Biologi og Kemisk Teknologi, har udviklet en ny metode til hurtig autentificering af kinesisk urtemedicin, inklusive Lingz
Team udvikler hurtig autentificeringsmetode for kinesisk medicinPolyUs forskerhold ledet af Dr Yao Zhongping, lektor ved Institut for Anvendt Biologi og Kemisk Teknologi, har udviklet en ny metode til hurtig autentificering af kinesisk urtemedicin, inklusive Lingz -
 Forskel mellem 316 og 308 rustfrit stålBåde 316 og 308 rustfrit stål har deres praktiske anvendelser. Der er kun subtile forskelle mellem disse to typer rustfrit stål. Anvendelser 316 rustfrit stål bruges ofte i marine applikationer, hv
Forskel mellem 316 og 308 rustfrit stålBåde 316 og 308 rustfrit stål har deres praktiske anvendelser. Der er kun subtile forskelle mellem disse to typer rustfrit stål. Anvendelser 316 rustfrit stål bruges ofte i marine applikationer, hv
- Usædvanlig magnetisk struktur understøtter muligvis næste generations teknologi
- Fremstilling af rent vand i en nødsituation
- Brug af neutroner og røntgenstråler til at analysere ældningen af lithiumbatterier
- Elbiler:Særlige farvestoffer kan forhindre unødvendige motorudskiftninger
- Mål:Lægemiddelresistente bakterier
- Klimaændringer, der påvirker migrationsmønstre for kiktraner, undersøgelse finder


