Beskriv, hvad der menes, når vand kaldes et polært molekyle?
Sidste artikelHvilket fosfat er polært?
Næste artikelEr elektroner jævnt fordelt over et molekyle?
 Varme artikler
Varme artikler
-
 Organiske metalskeletter lavet til at fungere som væskerEn udfordring for holdet var at få en krystallinsk MOF til at opføre sig som en porøs væske. Holdet opdagede, hvordan man modificerer overfladen af relativt store MOF-nanopartikler med passende kemi
Organiske metalskeletter lavet til at fungere som væskerEn udfordring for holdet var at få en krystallinsk MOF til at opføre sig som en porøs væske. Holdet opdagede, hvordan man modificerer overfladen af relativt store MOF-nanopartikler med passende kemi -
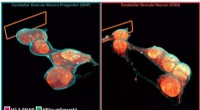 Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l
Mikroskopiteknik afslører cellers 3-D ultrastruktur i nye detaljerInde i en celle, tentakler vesikler shuttle last til sortering. DNA omarrangeres i kernen, efterhånden som stamceller differentieres til neuroner. Naboneuroner klamrer sig til hinanden gennem en web-l -
 Forskere finder frustration i batterimaterialerKunstnergengivelse af det faste elektrolytmateriale, viser lithium-atomer (lilla) bevæger sig inden for en matrix af anioner sammensat af bor (grøn), kulstof (grå) og brint (hvid) atomer. Kredit:Joel
Forskere finder frustration i batterimaterialerKunstnergengivelse af det faste elektrolytmateriale, viser lithium-atomer (lilla) bevæger sig inden for en matrix af anioner sammensat af bor (grøn), kulstof (grå) og brint (hvid) atomer. Kredit:Joel -
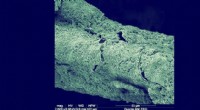 Lyser vejen til genbrug af kuldioxidSEM -billede viser den tætte og ensartede katodiske biofilm, som hovedsageligt omfatter kemolithoautotrofer, og kunne tjene som biokatalysatorer til effektiv carbondioxidomdannelse til acetat. Kredit:
Lyser vejen til genbrug af kuldioxidSEM -billede viser den tætte og ensartede katodiske biofilm, som hovedsageligt omfatter kemolithoautotrofer, og kunne tjene som biokatalysatorer til effektiv carbondioxidomdannelse til acetat. Kredit:
- Kan man tage fejl af den ødelagte majestætiske Kashmir-sø?
- Hackere retter sig mod Airbus -leverandører i jagten på kommercielle hemmeligheder
- Påmindelse:Din smartphone sporer sandsynligvis din placering
- Hvilken slags vilde dyr lever i ørkenerne?
- FORKLARER:Hvorfor hjemmebeskyttelse er vigtig ved naturbrande
- Tesla leverer den første kinesiske Model 3 til kunderne


