Hvordan påvirker pH ionbinding?
pH er på den anden side et mål for surheden eller basiciteten af en opløsning. Det bestemmes af koncentrationen af hydrogenioner (H+) i opløsningen. pH påvirker ikke direkte styrken af ionbindinger, men det kan påvirke opløseligheden og reaktiviteten af ioniske forbindelser.
I sure opløsninger er der en høj koncentration af H+ ioner. Dette kan konkurrere med andre positivt ladede ioner om binding med negativt ladede ioner, hvilket reducerer opløseligheden af ioniske forbindelser. I basiske opløsninger er der en lav koncentration af H+ ioner. Dette kan tillade ioniske forbindelser at opløses lettere og reagerer lettere med andre forbindelser.
Derfor kan pH indirekte påvirke ionbinding ved at påvirke opløseligheden og reaktiviteten af ioniske forbindelser.
Sidste artikelHvad er forskellen mellem naturligt kobber og kobber?
Næste artikelNår natriummetal reagerer med jernchlorid og dannes?
 Varme artikler
Varme artikler
-
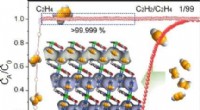 Adskillelse af sporacetylen fra ethylen i ultramikroporøse metal-organiske rammerKredit:Angewandte Chemie Ethylen, en vigtig råvare i den kemiske industri, indeholder ofte spor af acetylenforureninger, som skal fjernes. I journalen Angewandte Chemie , forskere beskriver en r
Adskillelse af sporacetylen fra ethylen i ultramikroporøse metal-organiske rammerKredit:Angewandte Chemie Ethylen, en vigtig råvare i den kemiske industri, indeholder ofte spor af acetylenforureninger, som skal fjernes. I journalen Angewandte Chemie , forskere beskriver en r -
 Forskere finder en måde at udnytte hele spektret af sollysForskere har vist, for første gang, at det er muligt at indsamle energi fra hele det synlige spektrum af sollys og transformere det, hurtigt og effektivt, til brint som brændstof. Kredit:David Monje p
Forskere finder en måde at udnytte hele spektret af sollysForskere har vist, for første gang, at det er muligt at indsamle energi fra hele det synlige spektrum af sollys og transformere det, hurtigt og effektivt, til brint som brændstof. Kredit:David Monje p -
 Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse,
Forskere udvikler en ny tilgang til at forudsige, hvordan væsker fryserKredit:Pixabay/CC0 Public Domain Forskere fra Queen Mary University of London har udviklet en ny beregningsmetode til bedre at forstå frysning i forskellige typer væsker. Processen med at fryse, -
 Lokalisering af d-orbitale elektroner i overgangsmetaller bestemtL3 og L2 fotoelektron L2,3 VV Auger-elektronsammenfaldskort af Cu (a) og Co (b) sammen med det sammenfaldende fotoelektronspektrum opnået ved integration af kortene langs Auger-elektronens kinetiske
Lokalisering af d-orbitale elektroner i overgangsmetaller bestemtL3 og L2 fotoelektron L2,3 VV Auger-elektronsammenfaldskort af Cu (a) og Co (b) sammen med det sammenfaldende fotoelektronspektrum opnået ved integration af kortene langs Auger-elektronens kinetiske
- Forskning viser mekanismen bag slid på atomskala
- Med innovative nanofibermembraner, stofmaskers effektivitet går op til 99%
- Osmose Fakta for Kids
- Deep-learning-system genererer specifik genrebaseret musik
- Et usynligt nøglehul via gennemsigtig elektronik
- Sådan løses algebraiske ligninger med dobbelte eksponenter


