Hvorfor udsagn beskriver en alternativ teori om syrer og baser?
Denne teori er baseret på begrebet elektronpar og kemisk binding, snarere end på det traditionelle koncept for hydrogenioner (H+) og hydroxidioner (OH-) som defineret af Arrhenius-teorien.
I Lewis-teorien ses en syre-base-reaktion som overførsel af et elektronpar fra basen til syren. Syren, som er elektronmangel, tager imod elektronparret fra basen, som er elektronrig. Dette resulterer i dannelsen af en kovalent binding mellem syren og basen.
Nogle eksempler på syrer og baser ifølge Lewis-teorien omfatter:
- Syrer:BF3, AlCl3, H+, CO2, SO3
- Baser:NH3, H2O, OH-, CH3COO-, pyridin
Lewis-teorien er særlig nyttig til at forstå adfærden af syrer og baser i ikke-vandige opløsningsmidler, hvor den traditionelle Arrhenius-teori muligvis ikke er anvendelig. Det giver også en mere generel ramme til forståelse af syre-base-reaktioner, da den omfatter en bredere række af reaktioner end Arrhenius-teorien.
På trods af nytten af Lewis-teorien er Arrhenius-teorien stadig meget brugt, især i indledende kemikurser, på grund af dens enkelhed og dens fokus på opførsel af syrer og baser i vandige opløsninger.
 Varme artikler
Varme artikler
-
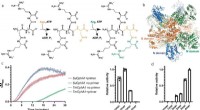 De overraskende schweizerkniv-lignende funktioner af et kraftfuldt enzymCphA1 struktur og aktivitet. a Skematisk diagram af de biosyntetiske reaktioner katalyseret af G- og M-domænerne af CphA1. b Den overordnede struktur af tetramer CphA1 fra Synechocystis sp. UTEX2470 (
De overraskende schweizerkniv-lignende funktioner af et kraftfuldt enzymCphA1 struktur og aktivitet. a Skematisk diagram af de biosyntetiske reaktioner katalyseret af G- og M-domænerne af CphA1. b Den overordnede struktur af tetramer CphA1 fra Synechocystis sp. UTEX2470 ( -
 Låst bevægelse i molekylær motor og rotorUniversity of Groningen professor i organisk kemi Ben Feringa. Kredit:University of Groningen / Jeroen van Kooten For at en motor skal drive maskineri, den lokale bevægelse skal oversættes til den
Låst bevægelse i molekylær motor og rotorUniversity of Groningen professor i organisk kemi Ben Feringa. Kredit:University of Groningen / Jeroen van Kooten For at en motor skal drive maskineri, den lokale bevægelse skal oversættes til den -
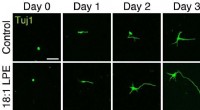 Oleoyl-LPE udøver neuritstimulering og neurobeskyttelseNeuritforlængelse, der fremmer handling Kredit:2021, Hisano et al., Shinshu universitet Lysophospholipider er fosfolipider, der kun har én fedtsyrekæde, og i de senere år, lysophospholipiders roll
Oleoyl-LPE udøver neuritstimulering og neurobeskyttelseNeuritforlængelse, der fremmer handling Kredit:2021, Hisano et al., Shinshu universitet Lysophospholipider er fosfolipider, der kun har én fedtsyrekæde, og i de senere år, lysophospholipiders roll -
 Fjernelse af giftige kemikalier fra vand:Ny miljøvenlig metodeKredit:CC0 Public Domain Forskere fra Swansea University har udviklet en ny miljøvenlig metode til fjernelse af giftige kemikalier fra vand. En nyopfundet maskine, kaldet Matrix Assembly Cluster
Fjernelse af giftige kemikalier fra vand:Ny miljøvenlig metodeKredit:CC0 Public Domain Forskere fra Swansea University har udviklet en ny miljøvenlig metode til fjernelse af giftige kemikalier fra vand. En nyopfundet maskine, kaldet Matrix Assembly Cluster
- Nye Ceres ser, da Dawn rykker højere
- Carbon nanorør åbner nye horisonter for neurovidenskab:styring af neural celleudvækst
- Ny undersøgelse viser, hvor meget føde havfugle har brug for
- NASA-NOAAs satellit-nat-tid nik til Norma
- Sådan laves en 3D-model til High School Biology
- Undersøgelse foreslår en forklaring på, hvordan blæksprutter ser farve på trods af sort-hvidt s…


