Begrænsninger af Arrhenius definitioner syrer og baser?
Anvendelse i vandige opløsninger:
Arrhenius-teorien er strengt anvendelig kun i vandige opløsninger, hvor vand tjener som opløsningsmiddel. Det tager ikke højde for syre-base-reaktioner i ikke-vandige opløsningsmidler, som kan involvere forskellige mekanismer og arter.
Ufuldstændig definition af baser:
Arrhenius-teorien definerer baser som stoffer, der producerer hydroxidioner (OH-), når de opløses i vand. Der er dog talrige basisstoffer, som ikke indeholder hydroxidioner, såsom ammoniak (NH3) og natriumbicarbonat (NaHCO3).
Ufuldstændig dissociation:
Ikke alle syrer og baser dissocierer fuldstændigt i vand for at producere ioner. Nogle forbindelser, såsom svage syrer og svage baser, dissocierer kun delvist, hvilket resulterer i en delvis frigivelse af H+ eller OH-ioner. Arrhenius-definitionerne skelner ikke mellem stærke og svage syrer og baser.
Syre-base-reaktioner uden protonoverførsel:
Arrhenius-teorien fokuserer udelukkende på protonoverførselsreaktioner, der involverer H+ ioner. Der er dog andre typer syre-base reaktioner, der ikke involverer protonoverførsel. For eksempel involverer reaktionen af Lewis-syrer og Lewis-baser deling af elektronpar snarere end protonoverførsel.
Ikke-vandige opløsningsmidler:
Arrhenius-teorien er begrænset til at beskrive syre-base-adfærd i vandige opløsninger. I ikke-vandige opløsningsmidler, såsom flydende ammoniak eller koncentreret svovlsyre, kan forskellige solvatiseringseffekter og reaktionsmekanismer være gældende, hvilket nødvendiggør en bredere definition af syrer og baser uden for rammerne af Arrhenius-teorien.
På grund af disse begrænsninger blev mere omfattende teorier, såsom Bronsted-Lowry-teorien og Lewis-teorien, udviklet for at give en mere generel og inkluderende forståelse af syre-base-reaktioner i forskellige kemiske systemer.
 Varme artikler
Varme artikler
-
 Magnetiske tænder lover materialer og energiGumboot chiton ( Cryptochiton stelleri ). Kredit:Kisailus Biomimetics &Nanostructured Materials Lab Et bløddyr med tænder, der kan slibe sten ned, kan være nøglen til at lave næste generation af
Magnetiske tænder lover materialer og energiGumboot chiton ( Cryptochiton stelleri ). Kredit:Kisailus Biomimetics &Nanostructured Materials Lab Et bløddyr med tænder, der kan slibe sten ned, kan være nøglen til at lave næste generation af -
 Kan sollys omdanne emissioner til nyttige materialer?Kredit:Pixabay/CC0 Public Domain Shaama Sharada kalder kuldioxid - den værste lovovertræder af den globale opvarmning - en meget stabil, meget glad molekyle. Det vil hun ændre på. For nylig off
Kan sollys omdanne emissioner til nyttige materialer?Kredit:Pixabay/CC0 Public Domain Shaama Sharada kalder kuldioxid - den værste lovovertræder af den globale opvarmning - en meget stabil, meget glad molekyle. Det vil hun ændre på. For nylig off -
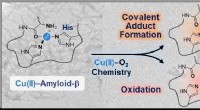 Koordinationskemi og Alzheimers sygdomKemiske modifikationer af koordinationssfæren i Cu(II)-amyloid-β ved hjælp af kobber-O2 kemi. Kredit:KAIST Det er for nylig blevet tydeligt, at interaktionerne mellem kobber og amyloid-β neurotoks
Koordinationskemi og Alzheimers sygdomKemiske modifikationer af koordinationssfæren i Cu(II)-amyloid-β ved hjælp af kobber-O2 kemi. Kredit:KAIST Det er for nylig blevet tydeligt, at interaktionerne mellem kobber og amyloid-β neurotoks -
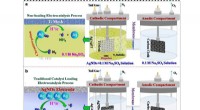 Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
Nyt elektrokatalysesystem realiserer omgivende ammoniakelektrosynteseSkematisk illustration af en. den ikke-belastende NRR-elektrokatalyseproces og b. den traditionelle elektrokatalyseproces, der belaster katalysatoren. Kredit:LI Wenyi Det er almindeligt kendt, at
- Hærens videnskabsmænd tager nye drejninger på kvanteforskning
- Hvorfor fordobler temperaturen ikke at øge temperaturen fra 3 grader C til 6 grader?
- En lav pris, højeffektiv katalysator, der omdanner kuldioxid til andre kemikalier
- Er der en grænse for, hvor varmt stof kan blive?
- Havene opvarmes endnu hurtigere end tidligere antaget
- Virksomheder med et stærkt omdømme kommer sig ikke så hurtigt fra PR -kriser som tidligere troet,…


