Hvordan er elektrisk tiltrækning vigtig i både ioniske og kovalente bindinger?
I ionbindinger er elektrisk tiltrækning den primære kraft, der holder de positivt ladede ioner (kationer) og negativt ladede ioner (anioner) sammen. Styrken af ionbindingen afhænger af ionernes ladninger og afstanden mellem dem. Jo større ladninger ionerne er og jo kortere afstanden er mellem dem, jo stærkere er ionbindingen.
Kovalente bindinger
I kovalente bindinger er elektrisk tiltrækning også vigtig, men det er ikke den eneste kraft, der holder atomerne sammen. I kovalente bindinger deler atomerne elektroner for at skabe en stabil elektronkonfiguration. Den elektriske tiltrækning mellem de positivt ladede kerner og de negativt ladede elektroner holder atomerne sammen.
I både ioniske og kovalente bindinger er elektrisk tiltrækning en vigtig kraft, der hjælper med at holde atomerne eller ionerne sammen. Styrken af den elektriske tiltrækning afhænger af ladningerne af ionerne eller atomerne og afstanden mellem dem.
 Varme artikler
Varme artikler
-
 Billeddannelse af sekventielle potentielle fordelingsændringer i elektroder under opladning/afladni…Ændringer i elektrisk potentialfordeling over en sammensat katode under opladning (a – f) og udladning (g – l) processer. Kredit:National Institute for Materials Science NIMS er lykkedes for først
Billeddannelse af sekventielle potentielle fordelingsændringer i elektroder under opladning/afladni…Ændringer i elektrisk potentialfordeling over en sammensat katode under opladning (a – f) og udladning (g – l) processer. Kredit:National Institute for Materials Science NIMS er lykkedes for først -
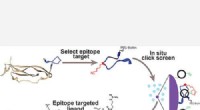 Bærbare sensorer kunne udnytte bioteknologi til at overvåge personlige, miljødataHurtig udviklingsproces af billig, meget stabile og modulære peptidbaserede syntetiske affinitetsmidler (PCCer) til proteinmål gennem brug af store peptidbiblioteker. Kredit:Genoptrykt med tilladelse
Bærbare sensorer kunne udnytte bioteknologi til at overvåge personlige, miljødataHurtig udviklingsproces af billig, meget stabile og modulære peptidbaserede syntetiske affinitetsmidler (PCCer) til proteinmål gennem brug af store peptidbiblioteker. Kredit:Genoptrykt med tilladelse -
 Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v
Video:Hvad er livet? Og vil vi finde det på andre planeter?Kredit:The American Chemical Society Kemi hjælper os med at finde ud af, hvordan livet kom i gang på Jorden og giver os molekyler at kigge efter på andre planeter. I denne episode af reaktioner, v -
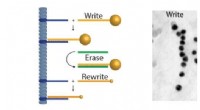 DNA som en supramolekylær byggestenKredit:Leiden Universitet Ph.d.-studerende Willem Noteborn har undersøgt supramolekylære strukturer. Disse kan være nyttige til indlæsning af medicin og signalmolekyler vedr. for eksempel, cellulæ
DNA som en supramolekylær byggestenKredit:Leiden Universitet Ph.d.-studerende Willem Noteborn har undersøgt supramolekylære strukturer. Disse kan være nyttige til indlæsning af medicin og signalmolekyler vedr. for eksempel, cellulæ
- Hvorfor sociale mediefirmaer vil kæmpe for at følge nye EU-regler om ulovligt indhold
- Nationale nødalarmer potentielt sårbare over for angreb
- Hvordan gener deler deres arbejdsområde
- To betydelige opvarmningsintervaller i det sydlige Kina siden 1850
- Livet på Mars:Japansk astronaut drømmer efter søopdagelse
- Hvilken type egenskaber er lettere at genkende fysisk eller kemisk?


