Hvordan gener deler deres arbejdsområde
Kunstnerens indtryk af en adskilt organisatorisk enhed af DNA, et topologisk associerende domæne (TAD). I dataanalysen optræder disse domæner som trekanter, der kan omstruktureres i forskellige væv. Kredit:Alessa Ringel/MPIMG
Lag af genkontrol gør det muligt for DNA fleksibelt at tilføje ny information. Gener og deres genetiske switche er organiseret i funktionelle enheder for at tænde eller slukke gener lige efter behov. At forstyrre disse enheder kan føre til sygdom, men en ny undersøgelse gør det klart, at de er mere robuste og fleksible end tidligere antaget. Et internationalt team af forskere fandt ud af, at et gen stadig kan fungere, selv når nye DNA-segmenter bliver indsat i den samme genomiske organisatoriske enhed.
To meter DNA er proppet ind i den lille kerne af hver menneskelig celle. For at give cellen den rigtige information på det rigtige tidspunkt pakkes og bundtes DNA-molekylet effektivt i funktionelle enheder. Gener samles normalt med deres kontrolsekvenser for at bygge fysisk adskilte arbejdsrum. Men hvad sker der, når disse enheder bliver forstyrret under evolutionen – eller i genomet af en individuel patient?
"Nogle af de genomiske omlejringer, vi ser i klinikken, forårsager sygdom, mens andre ikke gør," siger Stefan Mundlos fra Charité—Universitätsmedizin Berlin og leder af forskningsgruppen Development &Disease ved Max Planck Institute for Molecular Genetics (MPIMG). "Vi forstår stadig ikke helt, hvorfor det er tilfældet."
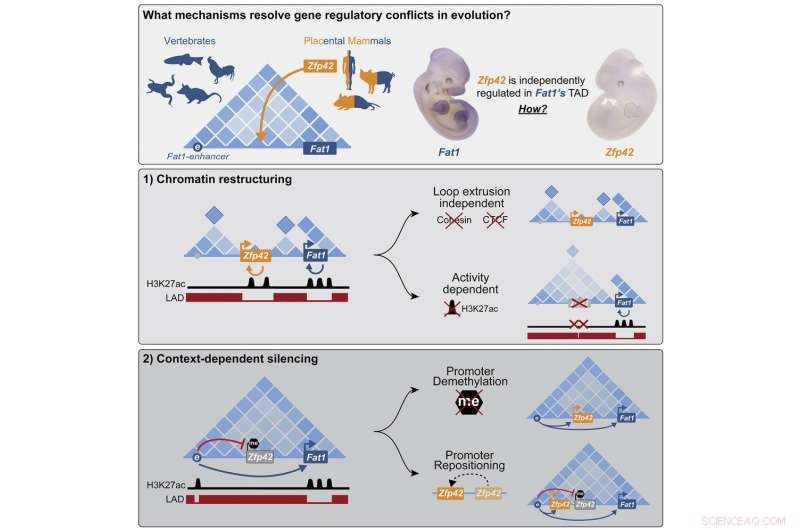
Faktisk indeholder mange dele af genomet regulatoriske konflikter. En ny undersøgelse offentliggjort i tidsskriftet Cell giver de første hints, hvordan de løses. Mundlos' forskerhold undersøgte et eksempel, hvor et nyt gen med succes er blevet integreret i genomet uden at forstyrre de eksisterende kontrolmekanismer for nabogener. Holdet håbede, at dette også kunne bruges til at drage konklusioner om lignende forhold i patienters celler.
Forskerne udforskede en mutation, der skete i forfaderen til alle placentale pattedyr, en gruppe, der inkluderer mennesker, men ikke pungdyr som opossum. Mutationen indsatte det nye gen Zfp42 lige ind i arbejdsområdet for det vigtige udviklingsgen Fat1, et gen, der er involveret i vækst og migration af celler.
"Vi fandt ud af, at celler klare den uønskede gæst med to separate mekanismer, afhængigt af situationen, hvor generne er nødvendige," siger Michael Robson, der har ledet projektet. "I visse væv dæmpes det nye gen epigenetisk og slukkes helt. Under tidlig udvikling af embryonet er begge gener imidlertid aktive, og cellen genopbygger denne del af genomet til nye funktionelle enheder, der muliggør individuel kontrol."
En ny på værkstedet
Robson, hans ph.d. studerende Alessa Ringel, og deres kolleger undersøgte det organisatoriske arbejdsområde i Fat1. Ligesom mange andre gener bliver det instrueret i at tænde på bestemte tidspunkter og steder af andre DNA-sekvenser kaldet forstærkere. For at tillade forstærkere og gener at kommunikere, foldes og bøjes DNA derefter for at bringe dem sammen til et beskyttet arbejdsrum. Disse funktionelle arbejdsenheder af DNA kaldes topologisk associerede domæner (TAD'er).
Hos kyllinger eller opossums er kun Fat1-genet placeret i samme TAD som dets forstærkere. Da forskeren brugte "Hi-C"-teknikken til at se, hvilke dele af DNA'et oftest rører hinanden, opførte genet og dets forstærker sig som forventet. Hos disse dyr syntes DNA'et at krølle sammen til en enkelt kugle, hvilket tillod begge genetiske sekvenser at blande sig og derved aktivere Fat1.
"Men hos placenta pattedyr som mus eller mennesker er det lidt mere kompliceret," forklarer Ringel, som er førsteforfatter til publikationen. Lige mellem Fat1-genet og dets forstærker er der dette nye gen kaldet Zfp42. Den samme forstærker bør kontrollere begge gener, men dette er ikke tilfældet. "Begge gener ser ud til at klare sig fint - de har fuldstændig uafhængig adfærd og bliver aktive i forskellige væv på forskellige tidspunkter af udviklingen."
Grafisk abstrakt. Kredit:Celle (2022). DOI:10.1016/j.cell.2022.09.006
Gå på vågeblus eller genopbyg dit arbejdsområde
For at komme til bunds i spørgsmålet om, hvordan generne formår at undgå hinanden, sammenlignede forskerne celler fra forskellige musevæv:det udviklende embryonale lem og embryonale stamceller.
Fra disse undersøgelser lærte forskerne, at forstærkeren i embryonale lemmer faktisk kontakter begge gener - men Zfp42 forbliver inaktiv. Som det viser sig, er den nyankomne stadig i samme arbejdsrum, men sover stille i et hjørne. Genet var blevet dæmpet af DNA-methylering, en kemisk modifikation, der låser gener i en off-state. Men for at få Zfp42-genet til at sove, skal det være præcis på det rigtige sted. Så snart forskerne eksperimentelt klippede og klistrede det lidt til hver side, blev det aktiveret af Fat1's enhancer.
Forskerne var overraskede over at finde ud af, at i cellerne i de embryonale musestamceller er DNA'et omkring de to gener organiseret helt anderledes. Zfp42 og Fat1 bygger nu deres egne fysisk adskilte arbejdsområder med deres egne respektive forstærkere.
Den originale TAD opdeles i mindre DNA-klatter for at adskille de to gener. Dette var tydeligt ikke kun fra Hi-C-eksperimenter, der kortlagde kontaktpunkterne mellem DNA-segmenter, men også fra højtopløselige mikroskopiske billeddannelser og computermodeller, som viste, at hvert gen etablerede sit eget lille arbejdsområde.
Et robust og fleksibelt system til genetisk kontrol
Disse to nye mekanismer afslører, hvordan et enkelt DNA "arbejdsområde" let kan modificeres til at være vært for helt forskellige genaktiviteter. "Det er fascinerende at studere, hvordan forskellige lag af genkontrol komplementerer hinanden," siger Ringel. "Vi er blevet overrasket over vores genomers fleksibilitet til at tilpasse og kontrollere gener i forskellige situationer. For eksempel viser vores resultater, at TAD'er kan have dynamiske snarere end statiske DNA-strukturer."
Fat1-genets TAD er blevet stabilt opretholdt i hundreder af millioner af års evolution fra fisk og frøer til pungdyr, tilføjer projektleder Robson. "TAD-arbejdsområder virker i starten skrøbelige, da så meget kan gå galt, hvis de bliver forstyrret," siger han. "Men nye gener skal et sted hen, og vi viser, hvordan evolutionen effektivt kan modificere regulatoriske domæner for sikkert at tilføje nye gener og funktioner."
"Interessant nok afspejler denne evolutionære indstilling, hvad vi ofte ser hos patienter med ekstreme genomiske ændringer som chromothripsis," siger Mundlos. "Disse patienter kan have knuste kromosomer, men har stadig kun relativt milde symptomer. Dette kunne forklares gennem disse yderligere reguleringsmekanismer, der kompenserer for skadelige virkninger ved at bruge de værktøjer, genomet har til sin rådighed." + Udforsk yderligere
Udforskning af molekylære grænser i DNA
 Varme artikler
Varme artikler
-
 Yderligere 2 hvaler dør i Australien, da strandingsdødsfald når op på 200Hvaler er strandet på Ocean Beach ved Macquarie Harbour på vestkysten af Tasmanien i Australien, onsdag den 21. september 2022. Yderligere to hvaler døde fredag den 23. september 2022 i Australien
Yderligere 2 hvaler dør i Australien, da strandingsdødsfald når op på 200Hvaler er strandet på Ocean Beach ved Macquarie Harbour på vestkysten af Tasmanien i Australien, onsdag den 21. september 2022. Yderligere to hvaler døde fredag den 23. september 2022 i Australien -
 Hvordan appellerer lyse farver til børn?Børn tager verden rundt omkring sig gennem deres øjne, og lyse farver er et af de første aspekter af synet, der hjælper dem med at skelne form og kategorisere objekter. Disse farver appellerer til små
Hvordan appellerer lyse farver til børn?Børn tager verden rundt omkring sig gennem deres øjne, og lyse farver er et af de første aspekter af synet, der hjælper dem med at skelne form og kategorisere objekter. Disse farver appellerer til små -
 Sådan fungerer telomererTelomerer (i hvidt) dækker enderne af menneskelige kromosomer, beskytter de genetiske oplysninger mod skader. Billedet er tilladt af Human Genome Program Science fiction -klassikeren fra 1982 fra Bla
Sådan fungerer telomererTelomerer (i hvidt) dækker enderne af menneskelige kromosomer, beskytter de genetiske oplysninger mod skader. Billedet er tilladt af Human Genome Program Science fiction -klassikeren fra 1982 fra Bla -
 Populære sportsfisk er adfærdshæmmede fra eksponering for råolie, viser undersøgelseMahi-mahi udsat for olie og mærket med pop-up satellit tags er klargjort til frigivelse. Kredit:Grosell Lab, Rosenstiel School of Marine, Atmospheric and Earth Science Et første af sin slags forskn
Populære sportsfisk er adfærdshæmmede fra eksponering for råolie, viser undersøgelseMahi-mahi udsat for olie og mærket med pop-up satellit tags er klargjort til frigivelse. Kredit:Grosell Lab, Rosenstiel School of Marine, Atmospheric and Earth Science Et første af sin slags forskn
- Forskere mener, at evolution kan redde koralrev, hvis vi lader det
- At skabe konflikt mellem landbrug og bevaring skader alle
- De første resultater fra Cassinis sidste mission fase viser protoner af ekstreme energier mellem pl…
- Study bruger computervisionsalgoritme til at studere Google Street View-billeder for tegn på byænd…
- Forskere undersøger, hvordan forskellige flydende organeller i celler skabes
- Usædvanligt materiale kan forbedre pålideligheden af elektronik og andre enheder


