Hvorfor har ioniske forbindelser en samlet neutral elektrisk ladning?
Overvej for eksempel den ioniske forbindelse natriumchlorid (NaCl). Natriumatomer mister en elektron og bliver positivt ladede natriumioner (Na+). Kloratomer får en elektron og bliver negativt ladede chloridioner (Cl-). Når natrium- og kloratomer kombineres for at danne natriumchlorid, er den positive ladning af natriumionerne lig med den negative ladning af chloridionerne, hvilket resulterer i en samlet neutral elektrisk ladning.
Tiltrækningen mellem de positivt og negativt ladede ioner i en ionforbindelse kaldes elektrostatisk kraft eller ionbinding. Denne kraft holder ionerne sammen og opretholder forbindelsens strukturelle integritet.
Det er vigtigt at bemærke, at den neutrale ladning af en ionisk forbindelse er en makroskopisk egenskab, der gælder for forbindelsen som helhed. På det mikroskopiske niveau bevarer de individuelle ioner i forbindelsen deres respektive ladninger. Imidlertid er arrangementet og støkiometrien af ionerne sådan, at den samlede nettoladning er nul.
Sidste artikelHvor mange pi- og sigma-bindinger i kuldioxid?
Næste artikelHvilken slags grundstof kombineres i kovalent binding?
 Varme artikler
Varme artikler
-
 Origami inspirerer til ny teknologi til vævsregenereringUMass Lowell Prof. Gulden Camci-Unal arbejder sammen med studerende Xinchen Wu om biomaterialeforskning ved universitetets Saab Emerging Technologies and Innovation Center. Kredit:Edwin Aguirre for UM
Origami inspirerer til ny teknologi til vævsregenereringUMass Lowell Prof. Gulden Camci-Unal arbejder sammen med studerende Xinchen Wu om biomaterialeforskning ved universitetets Saab Emerging Technologies and Innovation Center. Kredit:Edwin Aguirre for UM -
 Ny hybridelektrolyt til højtydende Li-ion-batterierEt fotografi (venstre), henholdsvis et scanningselektronmikroskopbillede (i midten) og en skematisk illustration af sammensat elektrolytstruktur (til højre). Kredit:Grewal og Yabu. Li-ion-batterier
Ny hybridelektrolyt til højtydende Li-ion-batterierEt fotografi (venstre), henholdsvis et scanningselektronmikroskopbillede (i midten) og en skematisk illustration af sammensat elektrolytstruktur (til højre). Kredit:Grewal og Yabu. Li-ion-batterier -
 Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn
Egenskaber af katalysatorer studeret med gammastråleresonansKredit:Kazan Federal University Dampstøttede olieudvindingsmetoder til tunge aflejringer har længe været i fokus på Kazan Federal University. I særdeleshed, Der lægges stor vægt på in-situ forbræn -
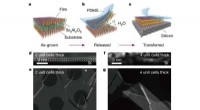 Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und
Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und
- På Fukushima -anlægget, en million tons hovedpine:radioaktivt vand
- Det tætteste udvalg af kulstof nanorør, der er dyrket til dato
- Er antallet af elektroner lig med protoner?
- Fodbold uden fans:Ny undersøgelse afslører effekten af tomme stadioner under pandemi
- Kan NH4Br være kovalent og ionbinding?
- Hvordan er syrer og baser forskellige?


