Hvor meget natriumnitrat produceres når 1,7G sølv og 1,5G iodid reagerede?
AgN03 + NaI → AgI + NaN03
Fra ligningen kan vi se, at 1 mol sølvnitrat reagerer med 1 mol natriumiodid for at producere 1 mol sølviodid og 1 mol natriumnitrat.
Den molære masse af sølvnitrat er 169,87 g/mol, og den molære masse af natriumiodid er 149,89 g/mol.
Derfor er 1,7 g sølv lig med 1,7 g / 169,87 g/mol =0,01 mol sølvnitrat.
Og 1,5 g natriumiodid er lig med 1,5 g / 149,89 g/mol =0,01 mol natriumiodid.
Da molforholdet mellem sølvnitrat og natriumiodid er 1:1, er den begrænsende reaktant i dette tilfælde sølvnitrat.
Derfor er den maksimale mængde natriumnitrat, der kan fremstilles, 0,01 mol natriumnitrat.
Den molære masse af natriumnitrat er 84,99 g/mol, så 0,01 mol natriumnitrat er lig med 0,01 mol * 84,99 g/mol =0,85 g natriumnitrat.
Derfor er mængden af natriumnitrat, der produceres, når 1,7 g sølv og 1,5 g iodid reagerer, 0,85 g.
Sidste artikelHvad er den kemiske sammensætning af S355 stålkvalitet?
Næste artikelHvordan laves papir kort?
 Varme artikler
Varme artikler
-
 Kantarelsvampe som smagsforstærkerDr. Verena Mittermeier fra formanden for fødevarekemi og molekylær sensorisk videnskab og Andreas Dunkel fra Leibniz-instituttet for fødevaresystembiologi foran deres institut. Kredit:Leibniz-LSB@TUM
Kantarelsvampe som smagsforstærkerDr. Verena Mittermeier fra formanden for fødevarekemi og molekylær sensorisk videnskab og Andreas Dunkel fra Leibniz-instituttet for fødevaresystembiologi foran deres institut. Kredit:Leibniz-LSB@TUM -
 Ny katalysator til brintproduktion er et skridt mod rent brændstofForsiden viser produktionen af brintgas, når elektroner og protoner mødes på ruthenium-ion-komplekserede grafitiske carbonnitrid-nanoark understøttet på grafenoverfladen. Billedet er baseret på en g
Ny katalysator til brintproduktion er et skridt mod rent brændstofForsiden viser produktionen af brintgas, når elektroner og protoner mødes på ruthenium-ion-komplekserede grafitiske carbonnitrid-nanoark understøttet på grafenoverfladen. Billedet er baseret på en g -
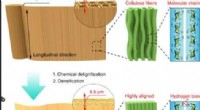 En enkeltcifret-mikrometer tykkelse træhøjttalerSkematisk af top-down tilgangen til direkte at transformere naturlig balsa til ultratynde træfilm. (a) Venstre:skematisk af det naturlige træ med dets porøse struktur. Midten:mikrostrukturen af cell
En enkeltcifret-mikrometer tykkelse træhøjttalerSkematisk af top-down tilgangen til direkte at transformere naturlig balsa til ultratynde træfilm. (a) Venstre:skematisk af det naturlige træ med dets porøse struktur. Midten:mikrostrukturen af cell -
 Tilpasning af legeringens mikrokemi til fejlfri metal 3D -printEn ny metode udviklet af Texas A&M-forskere optimerer legeringsegenskaber og procesparametre til at skabe overlegne 3D-printede metaldele. Her er vist et farvet elektronmikrograf af en nikkelpulverleg
Tilpasning af legeringens mikrokemi til fejlfri metal 3D -printEn ny metode udviklet af Texas A&M-forskere optimerer legeringsegenskaber og procesparametre til at skabe overlegne 3D-printede metaldele. Her er vist et farvet elektronmikrograf af en nikkelpulverleg
- Konstitutionel usikkerhed og politiske stridigheder sætter Grøn Brexit i fare, viser forskning
- C60 kunne danne en ny slags gel
- Forskere producerer 3D-model af ribosomet og visualiserer, hvordan det er lavet
- Forskere afslører, hvordan en dødelig svampeinfektion formskifter til et invasivt monster
- Hvordan virker en Slushie-maskine?
- Ørkenerne Renewable Resources


