Hvordan kan du se, om en kemisk ligning er endoterm?
1) Se efter tilstedeværelsen af en reaktantgas og en produktgas. Generelt, når en gas produceres i en reaktion, vil reaktionen være endoterm. Dette skyldes, at dannelsen af en gas kræver energi for at bryde bindingerne mellem de atomer eller molekyler, der udgør gassen.
2) Se efter en stor ændring i antallet af mol gas fra reaktanter til produkter. Hvis der er en stor stigning i antallet af mol gas fra reaktanter til produkter, vil reaktionen sandsynligvis være endoterm. Dette skyldes, at dannelsen af flere mol gas kræver mere energi for at bryde bindingerne mellem de atomer eller molekyler, der udgør gassen.
3) Se efter tilstedeværelsen af en fast reaktant og et flydende eller gasprodukt. Generelt, når en fast reaktant reagerer for at danne et væske- eller gasprodukt, vil reaktionen være endoterm. Dette skyldes, at brydningen af bindingerne mellem de atomer eller molekyler, der udgør det faste stof, kræver energi.
4) Se efter en reaktion, der producerer varme. Hvis en reaktion producerer varme, er den eksoterm. Hvis en reaktion absorberer varme, er den endoterm.
Her er nogle eksempler på endoterme reaktioner:
- Forbrænding af metan:
```
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
```
Denne reaktion er endoterm, fordi der er en stor stigning i antallet af mol gas fra reaktanter til produkter (4 til 3), og reaktionen producerer varme.
- Nedbrydning af vand:
```
2H2O(l) → 2H2(g) + O2(g)
```
Denne reaktion er endoterm, fordi der er en stor stigning i antallet af mol gas fra reaktanter til produkter (2 til 3), og reaktionen absorberer varme.
Sidste artikelHvad er ikke-ædle metaller?
Næste artikelHvordan identificeres endoterm reaktion i en ligning?
 Varme artikler
Varme artikler
-
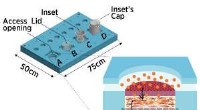 Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g
Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g -
 Skræddersyet kunstig perlemorEt tværsnit af en perlemor-imitation viser, at ved temperaturer på 800 grader Celsius og derover, der dannes knopper mellem blodpladerne, som størkner materialet. Kredit:Kunal Masania / ETH Zürich
Skræddersyet kunstig perlemorEt tværsnit af en perlemor-imitation viser, at ved temperaturer på 800 grader Celsius og derover, der dannes knopper mellem blodpladerne, som størkner materialet. Kredit:Kunal Masania / ETH Zürich -
 Forskere opdager stabilitet i hybride fotoelektriske nanomaterialerFig. 1. En computermodel af kulstofnanorør dækket af phthalocyaniner. Kredit:Pavel Krasnov Et hold af sibiriske forskere og udenlandske kolleger beregnede de parametre, der påvirker intensiteten a
Forskere opdager stabilitet i hybride fotoelektriske nanomaterialerFig. 1. En computermodel af kulstofnanorør dækket af phthalocyaniner. Kredit:Pavel Krasnov Et hold af sibiriske forskere og udenlandske kolleger beregnede de parametre, der påvirker intensiteten a -
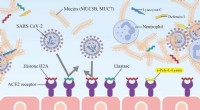 Ny nøglebeskyttelse mod COVID-19 fundet i spytSARS-CoV-2 overføres ved binding af spike-proteinet S1 på den virale kappe til den angiotensin-konverterende enzym 2 (ACE2)-receptor på plasmamembranen af humane celler. Histon H2A og elastaseprotei
Ny nøglebeskyttelse mod COVID-19 fundet i spytSARS-CoV-2 overføres ved binding af spike-proteinet S1 på den virale kappe til den angiotensin-konverterende enzym 2 (ACE2)-receptor på plasmamembranen af humane celler. Histon H2A og elastaseprotei
- Forskere udvikler nye kemiske biologiske værktøjer til at overvåge Parkinsons sygdom
- Undersøgelse af, hvordan Mei-yu nedbør reagerer på klimaændringer
- Store søers oversvømmelse:Advarselsskiltene om, at boliger skal flyttes
- Rumvejr truer det højteknologiske liv
- Patogen situation:Hvordan bakterier driver sig selv ud af et trangt sted
- Spiller Amor politik? Det 'noget særligt' kan være din kammerats politiske ideologi


