Hvad sker der, når en syre sættes til en base?
Den generelle kemiske ligning for neutralisering er:
```
Syre + Base → Salt + Vand
```
For eksempel, når saltsyre (HCl) tilsættes til natriumhydroxid (NaOH), sker følgende reaktion:
```
HCl + NaOH → NaCl + H2O
```
I denne reaktion kombineres hydrogenionerne fra HCl med hydroxidionerne fra NaOH for at danne vand, mens natriumionerne (Na+) fra NaOH kombineres med chloridionerne (Cl-) fra HCl og danner natriumchlorid (NaCl).
Neutraliseringsreaktioner er vigtige i mange daglige applikationer, såsom:
* Syre-base titreringer , som bruges til at bestemme koncentrationen af en ukendt syre eller base.
* Produktion af salte , såsom natriumchlorid (bordsalt) og kaliumnitrat (bruges i gødning).
* Behandling af halsbrand , som er forårsaget af overskydende mavesyre. Antacida, som er baser, kan neutralisere mavesyre og give lindring af halsbrand.
Neutraliseringsreaktioner er også vigtige i miljøet. For eksempel hjælper de med at regulere pH-værdien i naturlige vandområder, såsom søer og floder. Hvis pH-værdien i et vandområde bliver for surt, kan det skade vandlevende organismer. Neutraliseringsreaktioner kan hjælpe med at genoprette pH-balancen i vandområder og beskytte akvatiske økosystemer.
 Varme artikler
Varme artikler
-
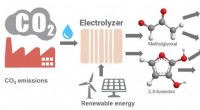 Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi
Hvordan man omdanner klimaforandrende kuldioxid til plast og andre produkterDette billede viser, hvordan kuldioxid kan omdannes elektrokemisk til værdifulde polymer- og lægemiddelprækursorer. Kredit:Karin Calvinho/Rutgers University-New Brunswick Rutgers-forskere har udvi -
 SMART-forskere udvikler hurtig og effektiv metode til at producere røde blodlegemerLaboratorieopsætning af mikrofluidisk sortering og oprensning af celler under dyrkning og fremstilling af røde blodlegemer. Kredit:Singapore-MIT Alliance for Research and Technology (SMART) Forske
SMART-forskere udvikler hurtig og effektiv metode til at producere røde blodlegemerLaboratorieopsætning af mikrofluidisk sortering og oprensning af celler under dyrkning og fremstilling af røde blodlegemer. Kredit:Singapore-MIT Alliance for Research and Technology (SMART) Forske -
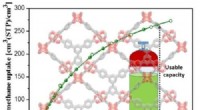 Naturgas kunne bygge bro mellem benzin og elektriske køretøjer takket være metal-organiske rammerLovende MOFer blev identificeret beregningsmæssigt og demonstrerer eksperimentelt bemærkelsesværdig metanoptagelse, der overgår kendte benchmarks både volumetrisk og gravimetrisk. Avanceret sæt af int
Naturgas kunne bygge bro mellem benzin og elektriske køretøjer takket være metal-organiske rammerLovende MOFer blev identificeret beregningsmæssigt og demonstrerer eksperimentelt bemærkelsesværdig metanoptagelse, der overgår kendte benchmarks både volumetrisk og gravimetrisk. Avanceret sæt af int -
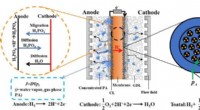 Forudsigelse af fordeling af phosphorsyre og vand i højtemperatur polymerelektrolytmembranbrændsel…Skematisk af katodekatalysatorlaget baseret på agglomerat-antagelsen. Kredit:Sun Mu Højtemperatur polymer elektrolytmembran brændselscelle (HT-PEMFC) kan anvendes i elektriske køretøjer og marine s
Forudsigelse af fordeling af phosphorsyre og vand i højtemperatur polymerelektrolytmembranbrændsel…Skematisk af katodekatalysatorlaget baseret på agglomerat-antagelsen. Kredit:Sun Mu Højtemperatur polymer elektrolytmembran brændselscelle (HT-PEMFC) kan anvendes i elektriske køretøjer og marine s
- NASA ser den tropiske cyklon Donna skæres fra hinanden
- LunaH-kort terningSat for at kortlægge månernes vandaflejringer
- Hvordan ændrer vandløb sig, når de flyder fra bjerge ned til sletter?
- Flokmentalitet:Er vi programmeret til at træffe dårlige beslutninger?
- Mystiske røde pletter på Merkur får navne - men hvad er de?
- Hvordan underjordiske svampe former skove


