Hvordan interagerer elektroner, når de danner en ionbinding?
For at forstå, hvordan elektroner interagerer, når de danner en ionbinding, lad os overveje eksemplet med natrium (Na) og chlor (Cl) atomer. Natrium har en valenselektron, som er løst bundet til kernen, mens klor har syv valenselektroner. Elektronkonfigurationerne af Na og Cl kan repræsenteres som:
Na:1s²2s²2p⁶3s¹
Cl:1s²2s²2p⁶3s²3p⁵
For at natrium kan opnå en stabil konfiguration (som neon), skal det miste en valenselektron. Klor skal på den anden side få en elektron for at fuldføre sin valensskal og blive som argon. Når disse atomer kommer tæt på hinanden, overfører natriumatomet sin løst holdte valenselektron til kloratomet.
Tabet af en elektron fra natrium resulterer i dannelsen af en positivt ladet natriumion (Na+), mens forstærkningen af en elektron ved chlor resulterer i dannelsen af en negativt ladet chloridion (Cl-). Disse modsat ladede ioner tiltrækkes stærkt af hinanden og danner en ionbinding.
I en ionbinding er de elektrostatiske kræfter mellem de positivt og negativt ladede ioner relativt stærke, hvilket resulterer i en stabil forbindelse. Styrken af en ionbinding afhænger af ladningerne af de involverede ioner og afstanden mellem dem. Jo større ladninger og jo kortere afstand, jo stærkere ionbinding.
Sidste artikelHvad observeres, når zinknitratsalt opvarmes?
Næste artikelAntal protoner i et atomelement?
 Varme artikler
Varme artikler
-
 Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at
Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at -
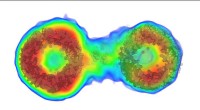 Kraftfuld ny billeddannelsesmetode afslører i detaljer, hvordan partikler bevæger sig i opløsningTakket være den nye metode, dette billede af et biomolekyle afslører dets indviklede indre struktur i orange, rød og gul. Indtil nu, forskere ville kun have kunnet se den blå kontur. Kredit: Naturens
Kraftfuld ny billeddannelsesmetode afslører i detaljer, hvordan partikler bevæger sig i opløsningTakket være den nye metode, dette billede af et biomolekyle afslører dets indviklede indre struktur i orange, rød og gul. Indtil nu, forskere ville kun have kunnet se den blå kontur. Kredit: Naturens -
 Let pincet kan bevæge sig, smelte, og spred mystiske biologiske isbjergeEksperimentel opstilling (a) Skematisk overgange observeret i nærvær af 0,2 M NaCl. Adsorberede GUVer gik ikke altid over til SLBer, og det er på disse strukturer, at domæner kan manipuleres. b Fluore
Let pincet kan bevæge sig, smelte, og spred mystiske biologiske isbjergeEksperimentel opstilling (a) Skematisk overgange observeret i nærvær af 0,2 M NaCl. Adsorberede GUVer gik ikke altid over til SLBer, og det er på disse strukturer, at domæner kan manipuleres. b Fluore -
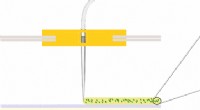 Oprettelse af materialer på en ny måde ved hjælp af 3D-trykbakterierKredit:ACS (Phys.org) – Et team af forskere ved Delft University of Technology har udviklet et middel til 3D-print af en gel indeholdende bakterier på en base for at skabe materialer på en ny måde
Oprettelse af materialer på en ny måde ved hjælp af 3D-trykbakterierKredit:ACS (Phys.org) – Et team af forskere ved Delft University of Technology har udviklet et middel til 3D-print af en gel indeholdende bakterier på en base for at skabe materialer på en ny måde
- Nye spor til, hvordan bakterier undslipper antibiotika
- Forskel mellem mutation og genetisk drift
- Hvordan laver man hjemmelavet kuldioxid?
- Høje niveauer af giftigt kviksølv i nogle arter af hajkød, finner udgør en fare for menneskers s…
- Video:Hvad Google kan lære af din Android -telefon
- Hvad er chromatinernes funktion?


