Hvad er kogepunktet for kæmpe kovalent?
For eksempel er kogepunktet for diamant, et kæmpe kovalent stof, 3550 °C. Dette er meget højere end kogepunktet for vand (100 °C), som er et molekylært stof med stærke hydrogenbindinger, men det er meget lavere end kogepunktet for ioniske forbindelser såsom natriumchlorid (1413 °C), som har stærke ionbindinger.
Følgende er nogle generelle tendenser i kogepunkterne for gigantiske kovalente stoffer:
* Kogepunktet stiger med stigende molekylvægt. Det skyldes, at jo tungere molekylet er, jo mere energi skal der til for at overvinde de intermolekylære kræfter og få det til at koge.
* Kogepunktet falder med stigende forgrening. Dette skyldes, at forgrening reducerer regelmæssigheden af den molekylære struktur og svækker de intermolekylære kræfter.
* Kogepunktet stiger med stigende polaritet. Dette skyldes, at polære molekyler har stærkere intermolekylære kræfter end ikke-polære molekyler.
Sidste artikelHvad betyder kæmpe kovalent?
Næste artikelHvad hedder en forbindelse med formlen K2O?
 Varme artikler
Varme artikler
-
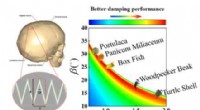 Forholdet mellem sart suturstruktur og dæmpning af biomaterialerFigur 1. De teoretiske modelforudsigelser tyder på, at suturstrukturer fundet i en række naturlige manifestationer har udviklet sig til deres optimale geometrier for at opnå den bedste dæmpningsydelse
Forholdet mellem sart suturstruktur og dæmpning af biomaterialerFigur 1. De teoretiske modelforudsigelser tyder på, at suturstrukturer fundet i en række naturlige manifestationer har udviklet sig til deres optimale geometrier for at opnå den bedste dæmpningsydelse -
 Paleopharmaceuticals fra baltisk rav kan bekæmpe lægemiddelresistente infektionerBaltisk rav er ikke kun smukt, men også en potentiel kilde til nye antibiotika. Kredit:Connor McDermott I århundreder, mennesker i de baltiske lande har brugt gammelt rav til medicinske formål. Se
Paleopharmaceuticals fra baltisk rav kan bekæmpe lægemiddelresistente infektionerBaltisk rav er ikke kun smukt, men også en potentiel kilde til nye antibiotika. Kredit:Connor McDermott I århundreder, mennesker i de baltiske lande har brugt gammelt rav til medicinske formål. Se -
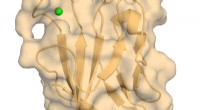 Forskere billede atomstruktur af vigtig immunregulatorHuman TIM-3 med bundet calcium. Kredit:Richard Blumberg, Brigham and Womens Hospital En ny undersøgelse foretaget af efterforskere fra Brigham and Womens Hospital giver en biofysisk og strukturel
Forskere billede atomstruktur af vigtig immunregulatorHuman TIM-3 med bundet calcium. Kredit:Richard Blumberg, Brigham and Womens Hospital En ny undersøgelse foretaget af efterforskere fra Brigham and Womens Hospital giver en biofysisk og strukturel -
 Styring af varmen åbner døren til næste generations belysning og displays i perovskit-LED'erPrinceton-forskere har forfinet fremstillingen af lysemitterende dioder fremstillet med krystallinske strukturer kendt som perovskitter, et mere effektivt og potentielt billigere alternativ til mate
Styring af varmen åbner døren til næste generations belysning og displays i perovskit-LED'erPrinceton-forskere har forfinet fremstillingen af lysemitterende dioder fremstillet med krystallinske strukturer kendt som perovskitter, et mere effektivt og potentielt billigere alternativ til mate
- Fodspor viser, at nogle tobenede dinosaurer var adrætte
- Undersøgelse undersøger, hvordan gentrifiers race påvirker detailudviklingen
- Eclipse-jagere tager til det sydlige Illinois for anden total solformørkelse på 7 år
- Dobbelt-duty-katalysator genererer brintbrændstof, mens den renser spildevand
- Sporing og forudsigelse af udbrudsrisiko for dengue, Zika og andre Aedes-overførte sygdomme
- Forskere foreslår speciel nano-lomme til overfladeforstærket Raman-spektroskopi-spredningsdetektio…


