Hvad angiver ioniseringskonstanten for en syre?
Ioniseringskonstanten udtrykkes typisk i form af molære koncentrationer og bestemmes af følgende ligevægtsligning:
HA ⇌ H+ + A-
Ka =[H+][A-]/[HA]
Hvor:
- Ka er ioniseringskonstanten eller syredissociationskonstanten
- [H+] er den molære koncentration af hydrogenioner (også kaldet hydroniumioner) i opløsningen
- [A-] er den molære koncentration af syrens konjugatbase
- [HA] er den molære koncentration af den udissocierede syre
Ioniseringskonstanten er en karakteristisk egenskab for hver syre og kan måles eksperimentelt under specificerede forhold, normalt ved en bestemt temperatur. Jo højere Ka-værdi, jo mere fuldstændig dissociation af syren og jo højere koncentration af H+ ioner, hvilket gør opløsningen mere sur. Omvendt indikerer en lavere Ka-værdi en svagere syre med en lavere tendens til at dissociere.
Sidste artikelEr dehydrerede løg forbindelser eller blandinger?
Næste artikelSyredessociationskonstanten for en opløst i vand er lig med?
 Varme artikler
Varme artikler
-
 Ny maskinlæringstilgang letter molekylær konformersøgning i komplekse molekylerKredit:Aalto Universitet CEST-forskere udviklede en ny maskinlæringstilgang baseret på et lav-energi latent rum (LOLS) og densitets funktionel teori (DFT) til at søge efter molekylære konformere.
Ny maskinlæringstilgang letter molekylær konformersøgning i komplekse molekylerKredit:Aalto Universitet CEST-forskere udviklede en ny maskinlæringstilgang baseret på et lav-energi latent rum (LOLS) og densitets funktionel teori (DFT) til at søge efter molekylære konformere. -
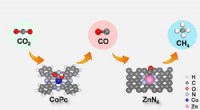 Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk
Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk -
 Forebyggelse, helbredende huller i tænderne med et bioaktivt peptidKredit:CC0 Public Domain hulrum, eller caries, er den mest udbredte ikke-smitsomme sygdom globalt, ifølge Verdenssundhedsorganisationen. At få boret og fyldt et hulrum på tandlægens kontor kan vær
Forebyggelse, helbredende huller i tænderne med et bioaktivt peptidKredit:CC0 Public Domain hulrum, eller caries, er den mest udbredte ikke-smitsomme sygdom globalt, ifølge Verdenssundhedsorganisationen. At få boret og fyldt et hulrum på tandlægens kontor kan vær -
 Udvikling af en strækbar vibrationsdrevet enhed ved hjælp af en flydende elektretDet nyudviklede flydende elektretmateriale (til venstre) og den bøjelige og strækbare vibrationsdrevne enhed (midten og højre). Kredit:NIST NIMS og AIST udviklede et flydende elektretmateriale, de
Udvikling af en strækbar vibrationsdrevet enhed ved hjælp af en flydende elektretDet nyudviklede flydende elektretmateriale (til venstre) og den bøjelige og strækbare vibrationsdrevne enhed (midten og højre). Kredit:NIST NIMS og AIST udviklede et flydende elektretmateriale, de
- Er det en kemisk forandring at lave glas af sand?
- Død ved spaghettificering:Forskere registrerer sidste øjeblikke af stjerne fortæret af sort hul
- UFO -hændelsen på Maury Island
- Flydende krystaller viser løfte om at kontrollere embryonale stamceller
- Fra insekt til lægemiddel - skovflåtspyt kan være nøglen til behandling af hjertesygdomme
- Formel for en Octagon


