Hvilken mængde hydrogenchloridgas produceres af 40 cm3 klor med brint?
Vi kan bruge støkiometri til at bestemme mængden af produceret hydrogenchloridgas.
Den afbalancerede kemiske ligning for reaktionen mellem klor og brint er:
Cl2(g) + H2(g) → 2HCl(g)
Ud fra ligningen kan vi se, at 1 mol klorgas reagerer med 1 mol brintgas og producerer 2 mol hydrogenchloridgas.
Vi får givet, at der bruges 40 cm3 klorgas. Vi kan konvertere dette til mol ved hjælp af den ideelle gaslov:
PV =nRT
hvor P er trykket, V er rumfanget, n er antallet af mol, R er idealgaskonstanten, og T er temperaturen.
Hvis vi antager standard temperatur og tryk (STP), har vi:
P =1 atm
V =40 cm3 =0,040 L
R =0,08206 L atm/mol K
T =273 K
Ved at indsætte disse værdier i ligningen får vi:
n =PV/RT =(1 atm)(0,040 L)/(0,08206 L atm/mol K)(273 K) =0,0017 mol
Da 1 mol klorgas producerer 2 mol hydrogenchloridgas, vil 0,0017 mol klorgas producere 0,0034 mol hydrogenchloridgas.
Vi kan derefter konvertere dette tilbage til volumen ved hjælp af den ideelle gaslov:
V =nRT/P =(0,0034 mol)(0,08206 L atm/mol K)(273 K)/(1 atm) =0,079 L
Derfor er mængden af produceret hydrogenchloridgas 0,079 L eller 79 cm3.
Sidste artikelHvad er stærk base anilin eller o-nitroanilin?
Næste artikelEr flydende ilt det samme som almindelig ilt?
 Varme artikler
Varme artikler
-
 Argon er ikke stoffet til metallisk brintEn illustration af Ar(H2)2 i diamantamboltcellen. Pilene repræsenterer forskellige måder, hvorpå spektroskopiske værktøjer studerer effekten af ekstreme tryk på stoffets krystalstruktur og molekylær
Argon er ikke stoffet til metallisk brintEn illustration af Ar(H2)2 i diamantamboltcellen. Pilene repræsenterer forskellige måder, hvorpå spektroskopiske værktøjer studerer effekten af ekstreme tryk på stoffets krystalstruktur og molekylær -
 Digital penicillinproduktionBioreaktor ved TU Wien. Kredit:Vienna University of Technology TU Wien og Sandoz GmbH har med succes implementeret en computersimulering i realtid af penicillinproducerende organismers komplekse v
Digital penicillinproduktionBioreaktor ved TU Wien. Kredit:Vienna University of Technology TU Wien og Sandoz GmbH har med succes implementeret en computersimulering i realtid af penicillinproducerende organismers komplekse v -
 Mere bæredygtig omdannelse af aminosyrer ved hjælp af lys i stedet for med varmeCecilia Bottecchia. Kredit:Angeline Swinkels Ph.D. kandidat Cecilia Bottecchia var en af de første, der lykkedes med at omdanne aminosyrer, som kan bruges til medicin, ved hjælp af synligt lys.
Mere bæredygtig omdannelse af aminosyrer ved hjælp af lys i stedet for med varmeCecilia Bottecchia. Kredit:Angeline Swinkels Ph.D. kandidat Cecilia Bottecchia var en af de første, der lykkedes med at omdanne aminosyrer, som kan bruges til medicin, ved hjælp af synligt lys. -
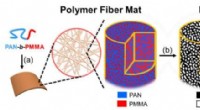 Porøs kulfiberforskning et skridt nærmere brug i bilindustrienSyntese af porøse kulfibre og belastning af MnO2. (a) En diblokcopolymer af polyacrylonitril-blok-polymethylmethacrylat (PAN-b-PMMA) spindes ind i en polymerfibermåtte. I den forstørrede udsigt, blokc
Porøs kulfiberforskning et skridt nærmere brug i bilindustrienSyntese af porøse kulfibre og belastning af MnO2. (a) En diblokcopolymer af polyacrylonitril-blok-polymethylmethacrylat (PAN-b-PMMA) spindes ind i en polymerfibermåtte. I den forstørrede udsigt, blokc
- Hvordan gamle planter begyndte at bruge vand, da de gik videre til land
- Sådan fungerer lufthavne
- Hvad vi kan lære af den oprindelige jordforvaltning
- Hvor godt klarer for tidligt fødte børn sig i skolen?
- Forskere udvikler billige oversvømmelsessensorer
- Billeder viser kinesisk rover på støvet, stenet Mars overflade


