Hvilke egenskaber ved vand kan direkte tilskrives tilstedeværelsen af hydrogenbindinger mellem molekyler?
1. Høj overfladespænding :Hydrogenbindinger skaber stærke sammenhængskræfter mellem vandmolekyler, hvilket resulterer i en høj overfladespænding. Denne egenskab tillader vand at danne dråber og modstå at blive spredt ud.
2. Høj specifik varmekapacitet :Vand har en høj specifik varmekapacitet, hvilket betyder, at det kræver en betydelig mængde energi at hæve dets temperatur. Dette skyldes, at brintbindinger absorberer og lagrer energi, før vandmolekyler kan få kinetisk energi.
3. Højt kogepunkt :Vands kogepunkt er relativt højt sammenlignet med andre lignende molekyler. Dette skyldes, at brintbindinger kræver mere energi for at blive brudt, før vand kan omdannes fra en væske til en gas.
4. Densitetsanomali :Vand er et af de få stoffer, der udvider sig ved frysning. Dette sker, fordi hydrogenbindinger i is danner en mere åben, mindre tæt struktur sammenlignet med flydende vand. Som følge heraf flyder is på overfladen af flydende vand, hvilket er afgørende for akvatiske økosystemer.
5. Universal opløsningsmiddel :Vands evne til at opløse en lang række stoffer skyldes dets polære natur og hydrogenbindingsevne. Mange molekyler og ioniske forbindelser kan danne brintbindinger med vandmolekyler, så de kan spredes og opløses.
6. Kapillærvirkning :Hydrogenbinding gør det muligt for vand at stige gennem smalle rør eller porøse materialer mod tyngdekraften. Dette fænomen, kendt som kapillærvirkning, er afgørende for vandtransport i planter og visse industrielle anvendelser.
7. Vedhæftning og sammenhæng :Hydrogenbindinger bidrager til den stærke adhæsion af vand til forskellige overflader (f.eks. hydrofile overflader) og sammenhængen mellem vandmolekylerne selv. Denne egenskab er afgørende for processer som vandtransport i planter, tåredannelse og dannelse af vanddråber.
 Varme artikler
Varme artikler
-
 Hvor gammelt er det fingeraftryk?Kredit:CC0 Public Domain Retsmedicinske dramaer på tv gør det nemt at afgøre, hvornår fingeraftryk blev efterladt på gerningsstedet. I virkeligheden nedbrydes olierne i fingeraftryk over tid, og de
Hvor gammelt er det fingeraftryk?Kredit:CC0 Public Domain Retsmedicinske dramaer på tv gør det nemt at afgøre, hvornår fingeraftryk blev efterladt på gerningsstedet. I virkeligheden nedbrydes olierne i fingeraftryk over tid, og de -
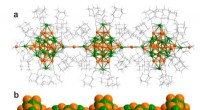 Teknik til fremstilling af funktionelle materialer baseret på polymerer af metalklyngerFigur a:Visualisering af en lineær polymer af 34-atom sølv-guldklyngerne med metal-metalbinding mellem klyngerne i vandret retning (guld:orange, sølv:grøn, ligandmolekyler (ethynyladamantan) er vist m
Teknik til fremstilling af funktionelle materialer baseret på polymerer af metalklyngerFigur a:Visualisering af en lineær polymer af 34-atom sølv-guldklyngerne med metal-metalbinding mellem klyngerne i vandret retning (guld:orange, sølv:grøn, ligandmolekyler (ethynyladamantan) er vist m -
 Vurdering af begyndelsen af calciumphosphatkernen ved hyperpolariseret real-time NMRFor at skabe effektive funktionelle materialer, naturen tilbyder de bedste opskrifter ved at levere evolutionært vellykkede koncepter, siger Dennis Kurzbach fra Institut for Biologisk Kemi. Kredit:© S
Vurdering af begyndelsen af calciumphosphatkernen ved hyperpolariseret real-time NMRFor at skabe effektive funktionelle materialer, naturen tilbyder de bedste opskrifter ved at levere evolutionært vellykkede koncepter, siger Dennis Kurzbach fra Institut for Biologisk Kemi. Kredit:© S -
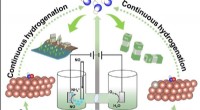 Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend
Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend
- Har Mælkevejens supermassive sorte hul en ledsager?
- Hvad er det elektroniske arrangement af et nitrogenatom?
- Subtile steriske forskelle afslører en model for Ni krydskobling succes
- Forskere ser på virkningerne af gentagne tørkeperioder på forskellige slags skove
- Forklarer New Zealands usædvanligt voksende gletschere
- Selvsamlende molekyler kan hjælpe i kræftbehandling


