Hvorfor viser jern 3 valens?
1. Elektronisk konfiguration: Jern har et atomnummer på 26, og dets elektroniske konfiguration er [Ar]3d64s2. '3d' orbitaler spiller en afgørende rolle i bestemmelsen af overgangsmetallers valens.
2. Tab af elektroner: For at opnå en stabil ædelgaskonfiguration har jernatomer en tendens til først at miste elektroner fra den yderste '4s' orbital efterfulgt af '3d' orbitaler.
- +2 Valency: Når jern mister sine to '4s' elektroner, opnår det en +2 oxidationstilstand, almindeligvis kendt som jernholdigt jern (Fe2+). Dette involverer tab af de to elektroner fra '4s' orbital.
- +3 Valens: I visse forbindelser mister jern en elektron mere fra '3d'-orbitalen ud over de to '4s'-elektroner. Dette resulterer i en +3 oxidationstilstand, også kaldet ferrijern (Fe3+). Fjernelsen af en ekstra elektron fra '3d'-orbitalen er mindre gunstig, hvilket forklarer, hvorfor +3-valensen er mindre almindeligt observeret.
Stabiliteten af disse valenser er påvirket af forskellige faktorer såsom elektronegativitet, ioniske radier, ligandfelteffekter og antallet af uparrede elektroner. Mens jern primært udviser +2 og +3 oxidationstilstande, kan det også udvise andre mindre almindelige valenser som +1, +4 og +6 i specifikke kemiske miljøer eller komplekser.
Sidste artikelSkelne mellem homogene og heterogene blandinger?
Næste artikelHvordan forhindrer salt forrådnelse?
 Varme artikler
Varme artikler
-
 Regn, regn, gå væk:Ny vandtætningsløsning opdagetKredit:CC0 Public Domain En ny belægningsløsning opdaget af forskere ved Simon Fraser University kan forvandle almindelige materialer til vandtætte overflader. Produktet vil være billigere at prod
Regn, regn, gå væk:Ny vandtætningsløsning opdagetKredit:CC0 Public Domain En ny belægningsløsning opdaget af forskere ved Simon Fraser University kan forvandle almindelige materialer til vandtætte overflader. Produktet vil være billigere at prod -
 Tæt og gennemtrængelig:Molekylær organisering af tight junctions afkodetSTED-mikroskopi afslører organisationen af TJ meshworks i nanoskala. et skema, der illustrerer den endogene TJ ved den mest apikale celle-til-celle kontakt i epitelceller. b Skema, der illustrerer T
Tæt og gennemtrængelig:Molekylær organisering af tight junctions afkodetSTED-mikroskopi afslører organisationen af TJ meshworks i nanoskala. et skema, der illustrerer den endogene TJ ved den mest apikale celle-til-celle kontakt i epitelceller. b Skema, der illustrerer T -
 Ny metode til at måle cellestivhed kan føre til forbedrede kræftbehandlingerI fremtiden, læger kunne bruge den metode, forskerne udviklede, til at spore en patient over tid for at se, hvordan et lægemiddel påvirker patientens kræftceller, senior forfatter Amy Rowat sagde. Kre
Ny metode til at måle cellestivhed kan føre til forbedrede kræftbehandlingerI fremtiden, læger kunne bruge den metode, forskerne udviklede, til at spore en patient over tid for at se, hvordan et lægemiddel påvirker patientens kræftceller, senior forfatter Amy Rowat sagde. Kre -
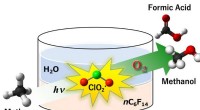 En radikal tilgang til metanoxidation til methanolFig.1:Chlordioxidradikal (ClO2 •) viste sig at virke som et effektivt oxidationsmiddel i den aerobe oxygenering af methan til methanol og myresyre under fotobestråling. Udbyttet af methanol og myresyr
En radikal tilgang til metanoxidation til methanolFig.1:Chlordioxidradikal (ClO2 •) viste sig at virke som et effektivt oxidationsmiddel i den aerobe oxygenering af methan til methanol og myresyre under fotobestråling. Udbyttet af methanol og myresyr
- Hvordan kan studiet af tæthed anvendes i den virkelige verden?
- En ny platform for Whole Foods? Hvordan en aftale kunne forringe dagligvarer
- Gravitationsbølger viser, at sorte huller i guldlok er sjældne
- 5 centrale temaer af biologi
- Sådan fungerer kold varme
- Monsunregn oversvømmer filippinske landsbyer, tusinder evakuerer


