Hvorfor er oxalsyre en svag elektrolyt?
Her er en mere detaljeret forklaring på, hvorfor oxalsyre er en svag elektrolyt:
1. Intermolekylær hydrogenbinding: Oxalsyremolekyler har to carboxylsyregrupper (-COOH), der kan danne stærke hydrogenbindinger med hinanden. Disse hydrogenbindinger holder molekylerne sammen og forhindrer dem i at dissociere fuldstændigt i vand.
2. Debiteringsadskillelse: Når oxalsyre dissocierer, danner den oxalationer (C2 O4 2- ) og hydrogenioner (H + ). Dog har oxalat-ionerne en negativ ladning, mens brint-ionerne har en positiv ladning. Disse modsatte ladninger tiltrækker hinanden og skaber en elektrostatisk kraft, der trækker ionerne sammen igen. Denne tiltrækning reducerer dissociationen af oxalsyre.
3. Opløsningsmiddeleffekter: Opløsningsmidlets polaritet spiller også en rolle i dissociationen af oxalsyre. Vand er et polært opløsningsmiddel, hvilket betyder, at det har både positive og negative områder. Denne polaritet kan stabilisere de ioner, der dannes, når oxalsyre dissocierer, hvilket reducerer deres tendens til at rekombinere. Men i mindre polære eller upolære opløsningsmidler stabiliseres ionerne ikke så effektivt, hvilket fører til en lavere grad af dissociation.
Sammenfattende er oxalsyre en svag elektrolyt på grund af intermolekylær hydrogenbinding, ladningsadskillelse og opløsningsmidlets polaritet. Disse faktorer forhindrer fuldstændig dissociation af oxalsyremolekyler, hvilket resulterer i en lav koncentration af ioner i opløsning.
 Varme artikler
Varme artikler
-
 Endelig, svaret på et brændende 40 år gammelt spørgsmålIndvendig bagside:Mekanisme, hvormed Tungsten Oxide fremmer aktiviteten af understøttede V2O5/TiO2-katalysatorer til NOX-reduktion:Strukturelle effekter afsløret af 51V MAS NMR-spektroskopi (Angew.
Endelig, svaret på et brændende 40 år gammelt spørgsmålIndvendig bagside:Mekanisme, hvormed Tungsten Oxide fremmer aktiviteten af understøttede V2O5/TiO2-katalysatorer til NOX-reduktion:Strukturelle effekter afsløret af 51V MAS NMR-spektroskopi (Angew. -
 Forskere beskriver reaktionsforløbet i to-lags tynde metalfilmTynd kobber/guldfilm lavet med transmissionselektronmikroskop. Kredit:Sergey M. Zharkov et. al. / Journal of Solid State Chemistry , 2018. Et team af forskere fra Siberian Federal University (SF
Forskere beskriver reaktionsforløbet i to-lags tynde metalfilmTynd kobber/guldfilm lavet med transmissionselektronmikroskop. Kredit:Sergey M. Zharkov et. al. / Journal of Solid State Chemistry , 2018. Et team af forskere fra Siberian Federal University (SF -
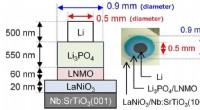 Udvidelse af grænserne for Li-ion-batterier – elektroder til hel-solid-state batterierBatterierne blev fremstillet ved at stable forskellige lag via tynd-film aflejringsmetoder. LNMO/Li 3 PO 4 grænsefladen viste spontan migration af Li-ioner og havde en hidtil uset lav modstand. Kr
Udvidelse af grænserne for Li-ion-batterier – elektroder til hel-solid-state batterierBatterierne blev fremstillet ved at stable forskellige lag via tynd-film aflejringsmetoder. LNMO/Li 3 PO 4 grænsefladen viste spontan migration af Li-ioner og havde en hidtil uset lav modstand. Kr -
 Syntetisk kemi tager anti-kræftforbindelser ud af søsneglen og ind i laboratorietDenne smarte søsnegl og dens lignende indeholder anti-kræftforbindelser i deres kroppe. Caltechs Brian Stoltz har udviklet en måde at skabe disse forbindelser på i laboratoriet. Kredit:Wikimedia Commo
Syntetisk kemi tager anti-kræftforbindelser ud af søsneglen og ind i laboratorietDenne smarte søsnegl og dens lignende indeholder anti-kræftforbindelser i deres kroppe. Caltechs Brian Stoltz har udviklet en måde at skabe disse forbindelser på i laboratoriet. Kredit:Wikimedia Commo
- Chemical Safety Board står over for en usikker fremtid
- Hvordan fungerer mexicanske springbønner?
- V-formet eller U-formet? Nogle økonomer er optimistiske med hensyn til virusgendannelse
- NASA leverer en infrarød analyse af tyfonen Halong
- Undersøgelse afslører nye spor om, hvordan 'Jordens termostat' styrer klimaet
- Kunne en lille partikel dæmme op for plagen med citrusgrønne?


