Hvordan bestemmer man en molekylformel ud fra den empiriske formel?
1. Bestem den empiriske formel:Den empiriske formel giver det enkleste forhold mellem grundstoffer til stede i en forbindelse. Hvis du ikke har den empiriske formel, skal du først bestemme den ved at analysere forbindelsens sammensætning.
2. Beregn den empiriske formelmasse:Den empiriske formelmasse er summen af grundstoffernes atommasse i den empiriske formel.
3. Beregn molekylmassen:Molekylmassen af forbindelsen er typisk et multiplum af den empiriske formelmasse. For at bestemme molekylmassen har du brug for eksperimentelle data, såsom stoffets molmasse opnået ved massespektrometri eller andre passende teknikker.
4. Beregn molekylformelmultiplikatoren:Divider molekylmassen med den empiriske formelmasse. Dette giver dig molekylformelmultiplikatoren, som repræsenterer, hvor mange gange den empiriske formel skal ganges for at opnå molekylformlen.
5. Multiplicer de sænkede i den empiriske formel:Multiplicer alle de sænkede i den empiriske formel med den molekylære formel-multiplikator opnået i trin 4.
6. Bekræft molekylformlen:Sørg for, at molekylformlen opnået i trin 5 opfylder alle eksperimentelle data og overholder loven om bevarelse af masse.
Husk, at molekylformlen giver det faktiske forhold mellem de elementer, der er til stede i forbindelsen, i betragtning af det faktiske antal atomer i stedet for det enkleste forhold.
 Varme artikler
Varme artikler
-
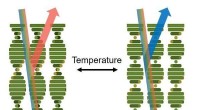 Farveændrende belægninger udløst af temperaturændringerFotoniske materialer har variable refleksionsegenskaber afhængigt af temperaturen. Kredit:Eindhoven University of Technology Farveskiftet kan påvirke vores opfattelse af objekter, bruges til at ad
Farveændrende belægninger udløst af temperaturændringerFotoniske materialer har variable refleksionsegenskaber afhængigt af temperaturen. Kredit:Eindhoven University of Technology Farveskiftet kan påvirke vores opfattelse af objekter, bruges til at ad -
 Teamet udvikler metode til neurale netberegninger i vandEt ionisk kredsløb, der omfatter hundredvis af ioniske transistorer. Kredit:Woo-Bin Jung/Harvard SEAS Mikroprocessorer i smartphones, computere og datacentre behandler information ved at manipulere
Teamet udvikler metode til neurale netberegninger i vandEt ionisk kredsløb, der omfatter hundredvis af ioniske transistorer. Kredit:Woo-Bin Jung/Harvard SEAS Mikroprocessorer i smartphones, computere og datacentre behandler information ved at manipulere -
 Nanomaterialestof ødelægger nervemidler i forhold til slagmarkenKompositter fremstillet af metal-organiske rammer kan ødelægge nervemidler under relevante forhold. Kredit:Journal of the American Chemical Society Northwestern University forskere har med succes
Nanomaterialestof ødelægger nervemidler i forhold til slagmarkenKompositter fremstillet af metal-organiske rammer kan ødelægge nervemidler under relevante forhold. Kredit:Journal of the American Chemical Society Northwestern University forskere har med succes -
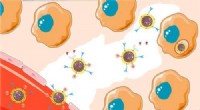 Bro over tumorvoldgrave med potente lægemiddelleveringspartiklerKredit:American Chemical Society På trods af store anstrengelser, kræft er fortsat en formidabel sygdom, med hver malign subtype, der reagerer forskelligt på terapeutika. En forhindring, der er sp
Bro over tumorvoldgrave med potente lægemiddelleveringspartiklerKredit:American Chemical Society På trods af store anstrengelser, kræft er fortsat en formidabel sygdom, med hver malign subtype, der reagerer forskelligt på terapeutika. En forhindring, der er sp
- Subaru Telescope og New Horizons udforsker det ydre solsystem
- Sådan beregnes Grade Scales
- Metode, der bruges til at spore myrer under jorden, kan revolutionere, hvordan vi måler snedybde fr…
- Sådan beregnes PH for NaOH
- Grønne tage forbedrer bymiljøet – så hvorfor har alle bygninger dem ikke?
- Virkningerne af bioakkumulering på økosystemet


