Hvad er molekylformlen for en forbindelse med en empirisk C4H9 og grammasse på 114 gram mol?
- Empirisk formel:$C_4H_9$
- Molekylvægt:114 gram/mol
Trin 1:Bestem den empiriske formelmasse
Den empiriske formel masse er summen af atommasserne af grundstofferne i den empiriske formel.
$C_4H_9$
4 (12,01 g mol^-1) + 9 (1,01 g mol^-1)
$=(4 × 12,01) (9 × 1,01) g/mol$
=48,04 + 9,09 g/mol
Empirisk formelmasse =57,13 g/mol
Trin 2:Beregn molekylformlen
Den molekylære formel er et multiplum af den empiriske formel.
$$ n=\frac{\text{Molekylmasse}}{\text{Empirisk formelmasse}}$$
$$ =\frac{\text{114 g/mol}}{\text{57,13 g/mol}}=2$$
Så den molekylære formel er to gange den empiriske formel:
$$ (C_4H_9) *2 =C_8H_{18}$$
Molekylformel:\(C_8H_{18}\)
 Varme artikler
Varme artikler
-
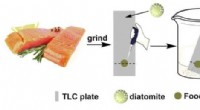 Fossiliserede alger lover løfte om forbedret test af fødevaresikkerhedKredit:Oregon State University Forskere har brugt de fossiliserede rester af alger til at tage et vigtigt skridt i retning af mere følsomt at kunne opdage skadelige forurenende stoffer i fødevarer
Fossiliserede alger lover løfte om forbedret test af fødevaresikkerhedKredit:Oregon State University Forskere har brugt de fossiliserede rester af alger til at tage et vigtigt skridt i retning af mere følsomt at kunne opdage skadelige forurenende stoffer i fødevarer -
 Gennemfyldt med huller:Gør fleksibel tyndfilmselektronik mere holdbarGentagen bøjning forårsager uoprettelig skade på fleksible ledere i form af mikroskopiske revner. At udvikle omkostningseffektive måder at løse dette problem på er en forudsætning, før fleksible elekt
Gennemfyldt med huller:Gør fleksibel tyndfilmselektronik mere holdbarGentagen bøjning forårsager uoprettelig skade på fleksible ledere i form af mikroskopiske revner. At udvikle omkostningseffektive måder at løse dette problem på er en forudsætning, før fleksible elekt -
 Forskere udvikler en ny kombineret proces til 3D-printInde i det 3-D-printede materiale (til højre) indeholder en gitterstruktur (til venstre) de tilsatte væsker. Kredit:Harald Rupp/Uni Halle Kemikere ved Martin Luther University Halle-Wittenberg (ML
Forskere udvikler en ny kombineret proces til 3D-printInde i det 3-D-printede materiale (til højre) indeholder en gitterstruktur (til venstre) de tilsatte væsker. Kredit:Harald Rupp/Uni Halle Kemikere ved Martin Luther University Halle-Wittenberg (ML -
 En tango med sammenfiltrede polymererChris Soteros. Kredit:University of Saskatchewan Mens statistikere er drevet af problemer i den virkelige verden, U of S matematik professor Chris Soteros er motiveret af den mere esoteriske adfær
En tango med sammenfiltrede polymererChris Soteros. Kredit:University of Saskatchewan Mens statistikere er drevet af problemer i den virkelige verden, U of S matematik professor Chris Soteros er motiveret af den mere esoteriske adfær
- Løsning af beslutningsproblemet med information beskrevet i naturligt sprog
- Forbundsværktøj:Fjernelse af kulaske ville tage 24 år
- Afslører hemmelighederne bag kemisk badaflejring
- Tager bid ud af slangegift
- Neutroner tillader analyse af polymergeler usædvanlige egenskaber
- Brug af beregningskemi til at producere billigere infrarøde plastiklinser


